빌리베르딘
| |
| 식별자 | |
|---|---|
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.003.675 |
| MeSH | Biliverdin |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
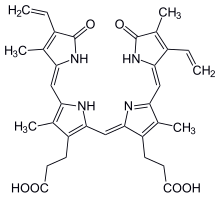
| C33H34N4O6 | |
| 몰 질량 | 582.646 |
| 녹는점 | > 300 °C |
| 위험 | |
| 주요 위험 | Irritant |
| 물질 안전 보건 자료 | Sigma-Aldrich |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
빌리베르딘(영어: biliverdin)은 녹색의 테트라피롤인 쓸개즙의 색소이며, 헴 이화대사의 산물이다.[1][2] 빌리베르딘은 때때로 멍에서 보이는 녹색을 띠는 색소이다.[2]
물질대사[편집]
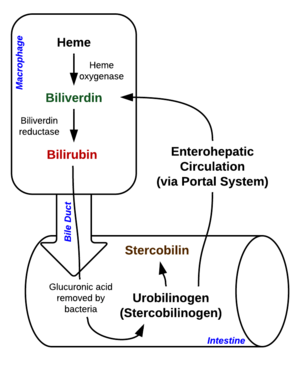
빌리베르딘은 적혈구에서 헤모글로빈의 헴 부분이 분해되어 생성된다. 대식세포는 오래된 적혈구를 분해하고, 헴을 헤모시데린과 함께 빌리베르딘으로 분해한다. 빌리베르딘은 보통 유리 빌리루빈으로 급격히 분해된다.[1][3]
빌리베르딘은 멍이 들었을 때 녹색으로 짧게 보인다. 빌리베르딘이 빌리루빈으로 분해되면 멍은 황색을 띠게 된다.[2]
 |
질병에서의 역할[편집]
빌리베르딘은 간질환을 앓고 있는 사람의 혈액에서 과량으로 발견되었다. 황달은 순환계와 조직에 빌리베르딘이나 빌리루빈이 (또는 둘 다) 축적되어 발생한다.[1] 황색 피부와 황색 공막은 간부전의 특징이다.
질병 치료에서의 역할[편집]
빌리베르딘은 일반적으로 헴 분해 과정의 단순한 부산물로 간주되지만, 빌리베르딘(및 다른 쓸개즙 색소)이 사람에서 생리적 역할을 한다는 증거들이 쌓이고 있다.[4][5]
빌리베르딘과 같은 쓸개즙 색소는 상당한 항돌연변이 및 항산화 특성을 가지기 때문에 유용한 생리학적 기능을 수행할 수 있다.[5] 빌리베르딘과 빌리루빈은 퍼옥실 라디칼의 강력한 제거제인 것으로 나타났다.[4][5] 이들은 또한 다환 방향족 탄화 수소, 헤테로사이클릭아민 및 산화제(이들은 모두 돌연변이원임)의 효과를 억제하는 것으로 나타났다. 일부 연구에 따르면 몸에 빌리루빈과 빌리베르딘의 농도가 높은 사람들은 암과 심혈관계 질환의 발병 빈도가 낮은 것으로 나타났다.[4] 빌리베르딘(및 다른 많은 테트라피롤 색소)은 HIV-1 프로테이스 저해제[6] 로서 기능할 뿐만 아니라 천식[5] 에 유익한 효과를 가질 수 있지만 이러한 결과를 확인하기 위한 추가적인 연구가 필요하다고 제안되었다. 현재 어떤 질병의 치료에서도 빌리베르딘을 사용하는 실질적인 의미는 없다.
사람이 아닌 동물에서[편집]
빌리베르딘은 조류의 알 껍질, 특히 청색 및 녹색 껍질에서 중요한 색소 성분이다. 청색 알 껍질은 갈색 알 껍질보다 상당히 높은 농도의 빌리베르딘을 함유하고 있다.[7]
연구 결과에 따르면 알 껍질의 빌리베르딘은 혈류에서 적혈구의 분해로부터가 아닌 껍질샘에서 생성되지만 물질의 근원이 테트라피롤이거나 혈장으로부터 유리된 헴이 아니라는 증거는 없다.
조류의 알 껍질에 존재하는 것과 함께, 다른 연구들은 빌리베르딘이 많은 해양 어류의 청록색 혈액, Manduca sexta 의 혈액, 나방과 나비의 날개, 개구리의 혈장과 알, 개의 태반에 존재한다는 것을 보여주었다.[8] 개에서 극히 드문 경우, 이것은 녹색 털을 가진 강아지로 태어날 수 있게 한다. 그러나 녹색 털은 태어나면 점차적으로 사라진다.[9] 동갈치(Belone belone) 및 관련 종에서 뼈는 빌리베르딘 때문에 밝은 녹색이다.
빌리베르딘은 뉴기니에서 발견되는 도마뱀과 Prasinohaema속의 녹색 혈액, 근육, 뼈, 점막층에도 존재한다. 빌리베르딘의 존재가 어떤 종류의 생태적 또는 생리적 적응인지는 확실하지 않다. 통계적으로 유의미한 상관관계가 확립되지 않았지만, 빌리베르딘의 축적이 말라리아 원충에 의한 말라리아의 감염을 막을 수 있을 거라고 제안되었다.[10] 캄보디아에 서식하는 개구리 종인 Chiromantis samkosensis 도 청록색 뼈와 함께 이러한 특성을 보여준다.[11]
형광 이미지에서[편집]

리엔지니어링된 세균 피토크롬과의 복합체에서 빌리베르딘은 생체 내 영상화를 위한 IR-발광 발색단으로 사용되어 왔다.[12][13] 폴리펩타이드 사슬의 번역 후 변형을 통해 그들의 발색단을 형성하는 형광 단백질과는 달리, 피토크롬은 외부 리간드(이 경우, 빌리베르딘)와 결합하고, 최초의 박테리오피토크롬 기반의 프로브의 성공적인 영상화는 외인성 빌리베르딘의 첨가를 필요로 했다.[12] 최근의 연구는 빌리베르딘에 높은 친화성을 갖는 박테리오피토크롬 기반 형광 단백질이 내인성 리간드만을 이용하여 생체 내에서 영상화 될 수 있고, 따라서 종래의 형광 단백질과 동일한 용이성을 갖는 것으로 입증되었다.[13] 빌리베르딘 결합 박테리오피토크롬 기반의 프로브의 2세대 및 다음 세대의 출현은 비침습적 생체 내 영상화의 가능성을 넓혔다.
새로운 종류의 형광 단백질은 남세균(Trichodesmium erythraeum)의 피코빌리 단백질, α-알로피코사이아닌으로부터 진화되었으며, 2016년에 작은 적색 형광 단백질(smURFP)로 명명되었다. 작은 적색 형광 단백질(smURFP)은 리에이스(lyase)로 알려진 외부 단백질의 필요 없이 발색단인 빌리베르딘을 자동촉매적으로 자기-결합시킨다.[14] 해파리 및 산호에서 유래한 형광단백질은 산소를 필요로 하며, 발색단 형성시 화학양론적 양의 과산화 수소를 생성한다.[15] 작은 적색 형광 단백질(smURFP)은 산소를 필요로 하지 않거나 과산화 수소를 생성하지 않으며 발색단으로 빌리베르딘을 사용한다. 작은 적색 형광 단백질(smURFP)은 큰 흡광 계수(180,000 M−1 cm−1)를 가지고 있으며 적당한 양자수율(0.20)을 갖는다. 이것은 녹색 형광 단백질에 필적하는 생물물리학적 밝기를 제공하며 산호에서 추출한 대부분의 적색 또는 원적색 형광 단백질보다 대략 2배 이상 더 밝다. 작은 적색 형광 단백질(smURFP)의 스펙트럼 특성은 유기 염료인 Cy5와 비슷하다.[14]
같이 보기[편집]
각주[편집]
- ↑ 가 나 다 Boron W, Boulpaep E. Medical Physiology: a cellular and molecular approach, 2005. 984-986. Elsevier Saunders, United States. ISBN 1-4160-2328-3
- ↑ 가 나 다 Mosqueda, L; Burnight, K; Liao, S (2005). “The Life Cycle of Bruises in Older Adults”. 《Journal of the American Geriatrics Society》 53 (8): 1339–1343. doi:10.1111/j.1532-5415.2005.53406.x. PMID 16078959.
- ↑ Seyfried, H; Klicpera, M; Leithner, C; Penner, E (1976). “Bilirubin metabolism (author's transl)”. 《Wiener Klinische Wochenschrift》 88 (15): 477–82. PMID 793184.
- ↑ 가 나 다 Bulmer, AC; Ried, K; Blanchfield, JT; Wagner, KH (2008). “The anti-mutagenic properties of bile pigments”. 《Mutation Research》 658 (1–2): 28–41. doi:10.1016/j.mrrev.2007.05.001. PMID 17602853.
- ↑ 가 나 다 라 Ohrui, T; Yasuda, H; Yamaya, M; Matsui, T; Sasaki, H (2003). “Transient relief of asthma symptoms during jaundice: a possible beneficial role of bilirubin”. 《The Tohoku Journal of Experimental Medicine》 199 (3): 193–6. doi:10.1620/tjem.199.193. PMID 12703664.
- ↑ McPhee, F; Caldera, PS; Bemis, GW; McDonagh, AF; Kuntz, ID; Craik, CS (1996). “Bile pigments as HIV-1 protease inhibitors and their effects on HIV-1 viral maturation and infectivity in vitro”. 《The Biochemical Journal》 320 (Pt 2): 681–6. doi:10.1042/bj3200681. PMC 1217983. PMID 8973584.
- ↑ Halepas, Steven; Hamchand, Randy; Lindeyer, Samuel E. D.; Brückner, Christian (2017). “Isolation of Biliverdin IXα, as its Dimethyl Ester, from Emu Eggshells”. 《Journal of Chemical Education》 94 (10): 1533–1537. Bibcode:2017JChEd..94.1533H. doi:10.1021/acs.jchemed.7b00449.
- ↑ Fang, LS; Bada, JL (1990). “The blue-green blood plasma of marine fish”. 《Comparative Biochemistry and Physiology B》 97 (1): 37–45. doi:10.1016/0305-0491(90)90174-R. PMID 2253479.
- ↑ “These Puppies Were Born with Green Fur”.
- ↑ Austin, C; Perkins, S (2006). “Parasites in a biodiversity hotspot: a survey of hematozoa and a molecular phyolgenetic analysis of plasmodium in New Guinea skinks”. 《Journal of Parasitology》 92 (4): 770–777. doi:10.1645/GE-693R.1. PMID 16995395.
- ↑ Lee Grismer, L.; Thy, Neang; Chav, Thou; Holden, Jeremy (2007). “A New Species of Chiromantis Peters 1854 (Anura: Rhacophoridae) from Phnom Samkos in the Northwestern Cardamom Mountains, Cambodia”. 《Herpetologica》 63 (3): 392–400. doi:10.1655/0018-0831(2007)63[392:ANSOCP]2.0.CO;2.
- ↑ 가 나 X. Shu; 외. (2009). “Mammalian expression of infrared fluorescent proteins engineered from a bacterial phytochrome”. 《Science》 324 (5928): 804–807. Bibcode:2009Sci...324..804S. doi:10.1126/science.1168683. PMC 2763207. PMID 19423828.
- ↑ 가 나 G.S.Filonov; Piatkevich, Kiryl D; Ting, Li-Min; Zhang, Jinghang; Kim, Kami; Verkhusha, Vladislav V; 외. (2011). “Bright and stable near infra-red fluorescent protein for in vivo imaging”. 《Nat Biotechnol》 29 (8): 757–761. doi:10.1038/nbt.1918. PMC 3152693. PMID 21765402.
- ↑ 가 나 Rodriguez, Erik A.; Tran, Geraldine N.; Gross, Larry A.; Crisp, Jessica L.; Shu, Xiaokun; Lin, John Y.; Tsien, Roger Y. (2016년 8월 1일). “A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein”. 《Nature Methods》 13 (9): 763–9. doi:10.1038/nmeth.3935. ISSN 1548-7105. PMC 5007177. PMID 27479328.
- ↑ Tsien, Roger Y. (1998년 1월 1일). “The Green Fluorescent Protein”. 《Annual Review of Biochemistry》 67 (1): 509–544. doi:10.1146/annurev.biochem.67.1.509. PMID 9759496.
