화학 물질

화학 물질(化學物質, chemical substance) 또는 순물질(純物質, pure substance)은 화학 분야에서 특정한 화합물을 동반한 물질을 가리킨다.[1]
- 화학 물질의 일반적인 한 예로 순수한 물을 들 수 있다. 이는 실험실에서 만들든 강에서 분리하였든 간에 수소 대 산소의 비와 속성이 같다. 이 밖에도 다이아몬드, 금, 소금 (염화 나트륨), 설탕 (자당) 등이 있다. 일반적으로 화학 물질은 고체, 액체, 기체, 플라스마 형태로 존재하며 온도나 압력의 변화에 따라 물질의 상태 사이에서 변화할 수 있다. 화학 반응은 하나의 화학 물질을 다른 물질로 바꾸어 놓는다.
- 화학의 연구 대상이 되는 물질. 또는 화학적 방법에 따라 인공적으로 만들어진 모든 물질
빛이나 열과 같은 에너지의 형태는 물질로 보지 않는다.
역사
[편집]화학 물질의 개념은 18세기 말에 조셉 프루스트가 염기 탄산동과 같은 일부 순수 화합물을 합성하면서 확립되었다.[2] 그는 "모든 화합물 표본은 같은 성분을 지니고 있다. 다시 말해 모든 표본은 질량 단위로 화합물에 존재하는 원소마다 비율이 같다."라고 추론하였다. 이를 일정 성분비의 법칙이라고 한다.[3] 그 뒤로 특히 유기화학 분야에서 화학 합성 방식이 진보하면서 더 많은 화학 원소의 발견, 원소를 분리해 내고 정화하는 데 쓰인 분석화학 분야에서의 새로운 기술, 그리고 현대 화학의 확립을 이끌었던 화합물 등의 개념은 대부분의 화학 교과서에서 볼 수 있다.
화학 원소
[편집]원소는 특정한 종류의 원자로 이루어진 화학 물질이므로 다른 원소와의 화학 반응으로 분리해 내거나 변경시킬 수 없다. 그러나 핵반응을 통하여서 다른 요소로 변형시킬 수 있다. 특정 원소 안의 모든 원자가 같은 수의 양성자를 갖고 있지만 다른 동위 원소에 다른 수의 중성자를 가지고 있을 수 있다. 120개의 원소가 알려져 있고 그 가운데 80개가 안정적이다.
화합물
[편집]화합물은 두 종류 이상의 원소가 결합하여 이루어진 순물질이다. 두 가지 이상의 원자가 일정한 비율로 결합하여 이루어지며, 성분 원소와는 성질이 전혀 다른 물질이다.
물질 대 혼합물
[편집]모든 물질은 다양한 원소와 화합물로 이루어져 있으나 이러한 것들은 서로 잘 섞인다. 혼합물은 하나 이상의 화학 물질을 포함하고 있으며 고정 성분을 지니고 있지는 않다. 원칙적으로 이들은 순수하게 기계적인 과정으로 구성 물질을 분리해 낼 수 있다. 버터, 흙, 나무가 일반적인 혼합물의 예이다.
이름 및 색인화
[편집]모든 화학 물질은 하나 이상의 조직 이름을 가지고 있는데 보통 IUPAC 명명법에 따른다. 이 체제의 대안으로 케미컬 애브스트랙트 서비스(CAS)를 사용할 수 있다.
| 일반 이름 | 조직 이름 | 화학 공식 | 화학 구조 | CAS 등록 번호 | InChI |
|---|---|---|---|---|---|
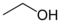
| 알코올, 또는 에틸-알코올 |
에탄올 | C2H5OH | [64-17-5] | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
분리, 정화, 특징 정의, 검증
[편집]순수 화학 물질은 혼합물에서 분리하여야 한다. 이를테면 천연 재료(표본에 수많은 화학 물질이 담겨 있을 수도 있음)로부터나 화학 반응을 통하여 걸러낼 수 있다.
각주
[편집]외부 링크
[편집] 위키미디어 공용에 화학 물질 관련 미디어 분류가 있습니다.
위키미디어 공용에 화학 물질 관련 미디어 분류가 있습니다.
같이 보기
[편집]