프랑크-스탈링 법칙

가로축은 좌심실 이완기말압력, 세로축은 좌심실 박출량을 나타내도록 그려진 평면에 우상향하다가 평평해지는 그래프가 그려져 있다. 이것이 바로 정상 심장의 스탈링 곡선이다. 심장의 수축력이 증가한 경우를 나타내는 그래프는 정상 심장의 스탈링 곡선보다 기울기가 가파르고, 심장의 수축력이 감소한 경우를 나타내는 그래프는 기울기가 더 완만하다.
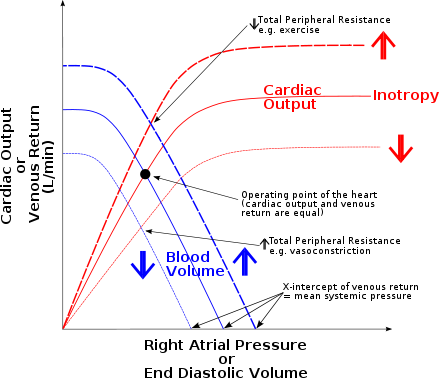
프랑크-스탈링 법칙(영어: Frank-Starling law) 또는 스탈링의 법칙(Starling's law) 또는 프랑크-스탈링 기전(Frank-Starling mechanism) 또는 심장의 법칙(영어: law of the heart)이란 동물 심장의 심실에 혈액이 많이 차서 심근세포가 늘어나 있을수록 수축력이 강해져서 박출량이 많아진다는 관계를 가리킨다.[1] 19세기 말-20세기 초에 결정적인 실험을 수행하여 법칙을 밝히는 데에 공헌했다고 여겨지는 두 생리학자 오토 프랑크와 어니스트 헨리 스탈링의 이름을 따서 명명되었으나,[1][2] 심실이 이완된 정도와 박출량의 관계는 19세기 중반부터 이미 알려져 있었다.[3] 스탈링의 공로는 근세포의 생리학을 바탕으로 법칙이 성립하는 원리를 밝혀 널리 알린 것이었다.[3]
이 법칙은 심장을 출력이 정해진 펌프와 같이 생각할 수 없음을 보여준다. 즉 정맥을 통해 심장으로 들어오는 혈액의 양이 어떤 이유로 늘어나더라도, 심장이 건강하면 이에 반응하여 더 강하게 수축함으로써 더 들어온 혈액이 쌓이지 않고 그대로 다시 방출될 수 있도록 한다.[1] 체순환과 폐순환의 혈류량이 자연스럽게 균형을 이루는 것, 갑자기 일어섰을 때 혈압이 잠시 내려가는 것, 출혈이나 탈수로 체내 혈액량이 줄면 혈압이 내려가는 것은 모두 이로 말미암은 것이다.[4]
심장주기상 심근세포가 수축하기 직전에 늘어나 있는 길이와 관련이 깊은 변수는 이완기말용적이다. 다만 이완기말압력이 이완기말용적과 대체로 비례하면서도 측정하기가 더 쉽기 때문에 더 흔히 사용하곤 한다.[5] 가로축에 이완기말 용적 또는 이완기말 압력을 나타내고 세로축에 박출량 또는 박출일(stroke work)을 나타내었을 때 그려지는 곡선을 심실 기능 곡선(영어: ventricular function curve)이라고 한다. 심실기능곡선은 심실 수축 기능의 한 가지 척도가 되는데, 이완기말압력이 똑같은데도 박출일이 크거나, 혹은 같은 만큼 박출일을 하는데도 이완기말용적이 작으면 수축력이 좋다고 평가하는 식이다. 즉 심장 수축력이 증가하면 곡선은 가팔라지고, 심부전 등으로 수축력이 감소하면 곡선은 완만해진다.[1][6]
프랑크-스탈링 법칙에는 한계가 있는데, 심근의 수축력이 무한정 강해질 수 없기 때문이다. 심근세포를 다양한 길이로 잡아 늘려서 장력을 측정해 보면 근섬유분절 길이가 2.2-2.3 ㎛일 때 최대가 되고, 더 길어지면 오히려 감소하기 시작한다. 건강한 사람의 심근세포 근섬유분절 길이는 보통 1.8-2.0 ㎛ 정도이고, 심근은 이보다 더 늘어나면 매우 뻣뻣해지기 때문에, 정상적인 상황이라면 심근이 너무 늘어나서 프랑크-스탈링 법칙이 성립하지 않게 되는 일은 없다.[7] 그러나 심부전 환자에서는 심장 기능이 심하게 악화하고 대단히 많은 양의 혈액이 심장에 쌓여서, 심실이 프랑크-스탈링 법칙을 거스를 정도로 확장되기도 한다. 이러한 비보상성 심부전(영어: decompensated heart failure)의 경우에는 줄어든 박출량을 보상하기 위해 콩팥이 체액을 재흡수하고, 이에 따라 혈액량이 늘어나면서 심근 수축력이 더욱 약해지는 악순환이 일어나게 된다.[8]
생리학
[편집]일반적으로 심근의 수축력을 결정하는 가장 중요한 요인은 세포 내의 칼슘 이온 농도이지만, 프랑크-스탈링 법칙의 원리는 이와 무관하다. 실제로 심근 조직을 분리한 다음 5분간 늘려 두면 심근세포 내 Ca2+ 농도가 상승하면서 장력도 강해지기 시작하는데, 이를 느린 힘 반응(영어: slow force response)이라고 부르며 생체 내에서 안렙 효과(영어: Anrep effect)를 일으킨다. 그런데 심근 조직의 장력은 세포 내 Ca2+ 농도가 상승하면서 느린 힘 반응이 일어나기도 전에, 심근을 잡아 늘린 직후부터 급격하게 강해진다. 그 정도를 견주면 즉각적인 반응으로 인한 장력 증가분이 전체의 60%가량을 차지하며, 느린 힘 반응으로 인한 장력 증가분은 전체의 40%가량이다. 즉 프랑크-스탈링 법칙은 Ca2+ 농도 상승과 무관하게 성립하며, 심근 수축력 증가에 기여하는 시기도 더 빠르고 정도도 더 크다.[7]
심근세포가 늘어났을 때에 Ca2+ 농도와 무관하게 심근 수축력이 빠르게 강해지도록 만드는 핵심 기제가 무엇인지는 여전히 논쟁의 대상이다.[7][9] 한 가지 가능성은 심근세포가 늘어나면서 액틴 미세섬유가 비효율적으로 중첩되는 구간이 줄어든다는 것이다. 액틴 미세섬유의 길이는 보통 1.0 ㎛이므로 근섬유분절이 2.0 ㎛ 미만이면 미세섬유가 근섬유분절의 반대쪽을 침범하게 되며, 특히 근섬유분절이 1.6 ㎛ 미만일 때에는 미세섬유가 Z선과 부딪힌다. 근섬유분절 길이가 늘어나면 이러한 비효율적인 중첩이 덜 일어나 수축력이 강해진다. 이러한 효과는 실제로 관찰되기는 하나 프랑크-스탈링 법칙에 기여하는 정도는 미미할 것으로 예상된다. 이상의 설명은 골격근에도 똑같이 적용할 수 있으나 심근은 골격근보다 길이에 따른 수축력 변화가 훨씬 심하기 때문이다. 더 중요한 기제는 Ca2+에 대한 반응성이 증가하는 현상인 것으로 보인다. 즉 심근세포가 길게 늘어나 있으면 Ca2+ 농도가 같아도 이에 반응해서 생겨나는 수축력이 더 강해지고, 반대로 같은 정도의 수축력을 만들어내기 위해 필요한 Ca2+ 농도는 더 낮아진다는 것이다.[7]
심근세포의 길이에 따른 Ca2+ 반응성 차이는 실험으로 확인할 수 있으나, 이러한 현상이 나타나는 이유가 무엇인지에 대해서는 역시 다양한 견해가 있다.[7] 격자 간격 가설(영어: lattice spacing hypothesis)에 따르면 심근세포가 길어질수록 액틴 미세섬유와 마이오신 섬유 사이의 거리가 줄어들기 때문에 같은 Ca2+ 농도에서도 더 많은 수의 액틴-마이오신 결합이 만들어지며, 이 때문에 수축력이 증가하게 된다. 한편 티틴 단백이 심근세포의 길이를 감지하여 Ca2+ 반응성을 조절하는 핵심 인자라는 가설도 있다.[7]
임상 사례
[편집]조기 심실 수축
[편집]확장기 기능 장애 – 심부전
[편집]역사
[편집]같이 보기
[편집]각주
[편집]- ↑ 가 나 다 라 Hall, Hall, & Guyton, 2021, pp. 123-124.
- ↑ Herring, Paterson, & Levick, 2018, p. 94.
- ↑ 가 나 Katz, Arnold M. (2002년 12월 3일). “Ernest Henry Starling, His Predecessors, and the “Law of the Heart””. 《Circulation》 (영어) 106 (23): 2986–2992. doi:10.1161/01.CIR.0000040594.96123.55. ISSN 0009-7322.
- ↑ Herring, Paterson, & Levick, 2018, p. 97.
- ↑ Bers, Donald M.; Borlaug, Barry A. 〈Mechanisms of Cardiac Contraction and Relaxation〉. Libby, Peter. 《Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine》 12판. Philadelphia: Elsevier. 889-912쪽. ISBN 978-0-323-72219-3.
- ↑ Loscalzo, Joseph; Libby, Peter; MacRae, Calum A (2018). 〈Basic Biology of the Cardiovascular System〉. Harrison, Tinsley Randolph; Jameson, J. Larry; Fauci, Anthony S.; Kasper, Dennis L.; Hauser, Stephen L.; Longo, Dan L.; Loscalzo, Joseph. 《Harrison's Principles of Internal Medicine》 20판. New York: McGraw-Hill Education. 1651-1661쪽. ISBN 978-1-259-64404-7.
- ↑ 가 나 다 라 마 바 Herring, Paterson, & Levick, 2018, pp. 89-91.
- ↑ Hall, Hall, & Guyton, 2021, pp. 271-274.
- ↑ LaCombe, Philip; Jose, Alvin; Basit, Hajira; Lappin, Sarah L. (2024). 《Physiology, Starling Relationships》. Treasure Island (FL): StatPearls Publishing. PMID 29083674.
참고문헌
[편집]- Herring, Niel; Paterson, David J.; Levick, J. R. (2018). 《Levick's Introduction to Cardiovascular Physiology》 6판. Boca Raton: CRC Press. ISBN 978-0-8153-6361-3.
- Hall, John E., Hall, Michael E., & Guyton, Arthur C. (2021). 《Guyton and Hall Textbook of Medical Physiology》 14판. Philadelphia: Elsevier. ISBN 978-0-323-59712-8.
