초산화 칼륨
보이기
| |
| 이름 | |
|---|---|
| IUPAC 이름
Potassium dioxide
| |
| 별칭
Potassium superoxide
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.031.574 |
| EC 번호 |
|
PubChem CID
|
|
| RTECS 번호 |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| KO2 | |
| 몰 질량 | 71.096 g·mol−1 |
| 겉보기 | yellow solid |
| 밀도 | 2.14 g/cm3, solid |
| 녹는점 | 560 °C (1,040 °F; 833 K) (decomposes) |
| 가수분해 | |
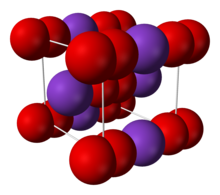
| 구조 | |
| Body-centered cubic (O− 2) 틀:Disputed inline | |
| 열화학 | |
표준 몰 엔트로피 (S
|
117 J·mol−1·K−1[1] |
표준 생성 엔탈피 (ΔfH⦵298)
|
−283 kJ·mol−1[1] |
| 위험 | |
| 주요 위험 | corrosive, oxidant |
| R-phrases (outdated) | 8-14-34 |
| S-phrases (outdated) | 17-27-36/37/39 |
| NFPA 704 (파이어 다이아몬드) | |
| 관련 화합물 | |
다른 음이온
|
산화 칼륨 과산화 칼륨 |
다른 양이온
|
en:Sodium superoxide |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
초산화 칼륨(Potassium superoxide)은 KO2 화학식을 갖는 무기 화합물이다.[2] 수분이 많은 대기에서 분해되는 황색의 상자성 고체이다. 초과산화물 음이온의 안정적인 염의 드문 예이다. 초산화 칼륨은 CO
2 스크러버, H
2O 제습기, 수중 호흡기의 O
2 발생기로서 사용된다.
생성 및 반응
[편집]초산화 칼륨은 산소 대기 중에 녹은 칼륨을 태움으로써 생성된다.[3]
- K + O
2 → KO
2
염은 이온 결합을 통해 K+
와 O−
2 이온으로 구성된다. O−O 거리는 1.28 Å이다.[4]
위험
[편집]초산화 칼륨은 독성 산화제이며 물, 산, 유기물, 그래파이트 분말을 포함한 다양한 물질과 화합물과 결합될 때 폭발 반응을 낼 수 있다. 건조한 초산화물조차도 케로신과 같은 유기농 기름과 결합할 때 민감한 폭발성 화합물을 만들어낼 수 있다.[5] 1999년, 오크리지 국립연구소에서 나크 금속 유출로부터 칼륨을 정제하다가 석유와 포화되면서 민감한 폭발을 일으켰다.[6]
각주
[편집]- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles》 6판. Houghton Mifflin. A22쪽. ISBN 978-0-618-94690-7.
- ↑ Hayyan M.; Hashim M. A.; AlNashef I. M. (2016). “Superoxide Ion: Generation and Chemical Implications”. 《Chem. Rev.》 116 (5): 3029–3085. doi:10.1021/acs.chemrev.5b00407. PMID 26875845.
- ↑ Jakob, Harald; Leininger, Stefan; Lehmann, Thomas; Jacobi, Sylvia; Gutewort, Sven (2007). 〈Peroxo Compounds, Inorganic〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. Wiley-VCH. doi:10.1002/14356007.a19_177.pub2. ISBN 978-3527306732.
- ↑ Abrahams, S. C.; Kalnajs, J. (1955). “The Crystal Structure of α-Potassium Superoxide”. 《Acta Crystallographica》 8 (8): 503–6. doi:10.1107/S0365110X55001540.
- ↑ Aerojet Nuclear Company (1975). “An Explosives Hazards Analysis of the Eutectic Solution of NaK and KO
2”. Idaho National Engineering Laboratory. - ↑ “Y-12 NaK Accident Investigation”. U.S. Department of Energy. February 2000. 2010년 5월 28일에 원본 문서에서 보존된 문서.
외부 링크
[편집] 위키미디어 공용에 초산화 칼륨 관련 미디어 분류가 있습니다.
위키미디어 공용에 초산화 칼륨 관련 미디어 분류가 있습니다.

