오플루오린화 안티모니
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
antimony(V) fluoride
| |||
| 별칭
antimony pentafluoride
pentafluoridoantimony | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.029.110 | ||
| EC 번호 |
| ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1732 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| SbF5 | |||
| 몰 질량 | 216.74 g/mol | ||
| 겉보기 | colorless oily liquid hygroscopic | ||
| 냄새 | pungent | ||
| 밀도 | 2.99 g/cm3[1] | ||
| 녹는점 | 8.3 °C (46.9 °F; 281.4 K) | ||
| 끓는점 | 149.5 °C (301.1 °F; 422.6 K) | ||
| Reacts | |||
| 용해도 | soluble in KF, liquid SO2 | ||
| 위험 | |||
| 주요 위험 | Releases hydrofluoric acid upon contact with water or biological tissues | ||
| 물질 안전 보건 자료 | ICSC 0220 | ||
| GHS 그림문자 |   
| ||
| 신호어 | 위험 | ||
| H302, H314, H332, H411, H412 | |||
| P260, P261, P264, P270, P271, P273, P280, P301+312, P301+330+331, P303+361+353, P304+312, P304+340, P305+351+338, P310, P312, P321, P330, P363, P391, P405, P501 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 0.5 mg/m3 (as Sb)[2] | ||
REL (권장)
|
TWA 0.5 mg/m3 (as Sb)[2] | ||
| 관련 화합물 | |||
다른 음이온
|
Antimony pentachloride | ||
다른 양이온
|
Phosphorus pentafluoride Arsenic pentafluoride Bismuth pentafluoride | ||
관련 화합물
|
Antimony trifluoride | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
오플루오린화 안티모니(Antimony Pentafluoride)는 화학식 SbF5를 가지는 무기 화합물이다. 이 무색의 점성을 가진 액체는 세상에서 가장 강력한 루이스 산이자 초강산의 일종인 플루오로안티몬산의 성분으로, 이 산은 액체상태의 플루오린화 수소산과 오플루오린화 안티모니를 2:1 비로 혼합했을 때 형성되는 가장 강력한 산이다. 거의 모든 알려진 화합물과 반응하는 능력이 주목할 만하다.[4]
제조[편집]
오염화 안티모니(SbCl5)를 무수 플루오린화 수소산과 반응시켜 얻는다.[5]
- SbCl5 + 5 HF → SbF5 + 5 HCl
삼플루오린화 안티모니(SbF3)와 플루오린 기체를 반응시켜 얻는 방법도 있다.[6]
- SbF3 + F2 → SbF5
구조 및 화학반응[편집]
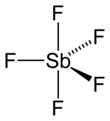
기체 상태의 SbF5는 그림처럼 각각의 플루오린 원자가 도형의 꼭짓점에 위치하는 삼각쌍뿔 모양의 분자 구조를 가지고있으며, 액체 및 고체 상태에서는 보다 복잡한 구조를 가진다.
액체는 각각의 Sb가 팔면체인 중합체를 포함하며 화학식은 [SbF4(μ-F)2]n로 표기한다(μ-F로 기술된 구조는 플루오린 원자가 2개의 SbF4를 연결하고 있는 것을 나타낸다). 결정질은 사면체형 분자기하구조이며, 이는 화학식이 [SbF4(μ-F)]4임을 의미한다. Sb4F4의 사슬에서 안티모니 원자와 플루오린 원자간의 결합간격은 2.02Å이고, 사슬을 형성하지 않는 나머지 플루오린 원자간의 결합간격은 1.82Å로 더 짧다.[7]
관련되어있는 종인 PF5와 AsF5는 고체 및 액체 상태의 단량체이며, 중심 원자의 크기가 더 작기 때문에 결합 능력에 대한 것이 제한된다. BiF5는 중합체로 존재한다.[8]
SbF5가 HF의 브뢴스테드-로우리 산의 산성도를 향상시키는 것과 같은 방식으로, 플루오린의 산화력을 증가시킨다. 이 효과는 산소의 산화로 설명된다.[9]
- 2 SbF5 + F2 + 2 O2 → 2 O2+ + 2 SbF6-
또한 오플루오린화 안티모니는 플루오린 화합물로부터 플루오린 기체를 발생시는 화학 반응에 사용되었다.
- 4 SbF5 + 2 K2MnF6 → 4 KSbF6 + 2MnF3 + F2
이 반응의 추진력은 SbF5가 지닌 플루오린화 이온과의 높은 친화도에서 비롯된다. 마법산, 플루오로안티몬산 등의 초강산 용액을 제조하기 위해 항상 SbF5를 사용하는 이유이기도 하다.
육플루오린화 안티몬산염[편집]
SbF5는 강력한 루이스 산이며, 예외적으로 플루오린화 이온과 결합하여 육플루오린화 안티몬산염(SbF6-)이라는 매우 안정적인 음이온을 형성한다. 다른 SbF5와 반응하여 대칭적인 분자구조의 부산물을 만든다.
- SbF5 + SbF6- → Sb2F11-
안전성[편집]
- SbF5는 많은 화합물과 격렬하게 반응하여 종종 위험한 플루오린화 수소 기체를 방출하며, 이는 피부와 눈에 대해 부식성이 강하기 때문에 취급에 대단한 주의가 요구된다.[10][11]
같이 보기[편집]
- 삼플루오린화 안티모니(SbF3)
- 오염화 안티모니(SbCl5)
- 오플루오린화 인(PF5)
- 오플루오린화 비소(AsF5)
- 오플루오린화 비스무트(BiF5)
각주[편집]
- ↑ Lide, David R., 편집. (2006). 《CRC Handbook of Chemistry and Physics》 87판. Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ 가 나 NIOSH Pocket Guide to Chemical Hazards. “#0036”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ World of Chemicals SDS
- ↑ Olah, George A.; Surya Prakash, G. K.; Wang, Qi; Li, Xing-ya (2001년 4월 15일). “Hydrogen Fluoride-Antimony(V) Fluoride”. Chichester, UK: John Wiley & Sons, Ltd. ISBN 0471936235.
- ↑ Grund, Sabina C.; Hanusch, Kunibert; Breunig, Hans J.; Wolf, Hans Uwe (2006년 7월 15일). “Antimony and Antimony Compounds”. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 3527306730.
- ↑ SCHENK, P.W.; BRAUER, G. (1963). 《Preparative Methods》. Elsevier. 3–107쪽. ISBN 9780123955906.
- ↑ Edwards, A. J.; Taylor, P. (1971). “Crystal structure of antimony pentafluoride”. 《Journal of the Chemical Society D: Chemical Communications》 (21): 1376. doi:10.1039/c29710001376. ISSN 0577-6171.
- ↑ Wiberg, Egon. (2001). 《Inorganic chemistry》. Academic Press. ISBN 0123526515.
- ↑ Shamir, Jacob; Binenboym, Jehuda; Malm, J. G.; Williams, C. W. (2007년 1월 5일). 《Dioxygenyl Salts》. Hoboken, NJ, USA: John Wiley & Sons, Inc. 39–42쪽. ISBN 9780470132456.
- ↑ “Antimony Pentafluoride”. Hoboken, NJ, USA: John Wiley & Sons, Inc. 2007년 3월 15일. ISBN 0470114738.
- ↑ “Antimony Pentafluoride”. Hoboken, NJ, USA: John Wiley & Sons, Inc. 2007년 3월 15일. ISBN 0470114738.