에너지 방출반응
보이기
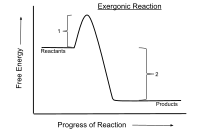
에너지 방출반응(영어: exergonic reaction)은 열화학에서 자유 에너지의 표준 변화가 음(-)인 화학 반응(자유 에너지의 순방출이 있음)이다.[1] 이것은 시스템이 닫혀 있고 초기 온도와 최종 온도가 동일한 경우 자발적인 반응임을 나타낸다. 일정한 압력과 온도의 닫힌계에서 일어나는 과정의 경우 깁스 자유 에너지가 사용되는 반면, 헬름홀츠 자유 에너지는 일정한 부피와 온도에서 일어나는 과정과 관련이 있다. 열역학 제2법칙에 따르면 전기 에너지 또는 광자 에너지의 투입 없이 일정한 온도에서 일어나는 모든 반응은 에너지 방출반응이다. 에너지 방출반응의 예로는 세포 호흡이 있다.
일정한 압력과 온도에서 에너지 방출반응의 자유 에너지 의 방출은 다음과 같이 표시된다.
에너지 방출반응이 자발적으로 일어난다고 언급되지만 이것은 반응이 관찰 가능한 속도로 일어날 것이라는 것을 의미하는 것은 아니다. 예를 들어 과산화 수소의 불균화는 자유 에너지를 방출하지만 적절한 촉매가 없는 경우에 매우 느리게 일어난다. 이러한 맥락에서 열망(eager)가 더 직관적인 용어가 될 것이라고 제안되었다.[2]
보다 일반적으로 에너지 방출(exergonic) 및 에너지 흡수(endergonic)라는 용어는 화학 반응뿐만 아니라 모든 과정에서의 자유 에너지의 변화와 관련된다. 대조적으로 발열(exothermic) 및 흡열(endothermic)이라는 용어는 일반적으로 열 교환과 관련된 과정 중 닫힌계에서의 엔탈피의 변화와 관련이 있다.
같이 보기[편집]
각주[편집]
- ↑ IUPAC Gold Book definition: exergonic reaction (exoergic reaction)
- ↑ Hamori, Eugene; James E. Muldrey (1984). “Use of the word "eager" instead of "spontaneous" for the description of exergonic reactions”. 《Journal of Chemical Education》 61 (8): 710. Bibcode:1984JChEd..61..710H. doi:10.1021/ed061p710.


