미토콘드리아 기질: 두 판 사이의 차이
영어판 위키(2023년 4월 11일 버전)를 참고하여 기존의 한국어판 문서의 내용을 보충함. |
|||
| 2번째 줄: | 2번째 줄: | ||
[[파일:Mitochondrion_mini.svg|섬네일|오른쪽|220px|미토콘드리아의 구조]] |
[[파일:Mitochondrion_mini.svg|섬네일|오른쪽|220px|미토콘드리아의 구조]] |
||
'''미토콘드리아 기질'''({{llang|en|mitochondrial matrix}})은 [[미토콘드리아]]에서 미토콘드리아 안쪽의 공간이다. "기질(基質, matrix)"이라는 단어는 이 공간이 상대적으로 수성(水性)인 [[세포질]]에 비해 점성을 가지고 있다는 사실에서 비롯된 것이다. 미토콘드리아 기질에는 [[미토콘드리아 DNA]], [[리보솜]], 가용성 [[효소]], 작은 유기분자, [[뉴클레오타이드]] [[보조 인자]] 및 [[무기 이온]]이 포함되어 있다.<sup>[1]</sup> 미토콘드리아 기질에 존재하는 효소들은 [[시트르산 회로]], [[산화적 인산화]], [[피루브산의 산화]], [[베타 산화|지방산의 β 산화]]와 같은 [[아데노신 삼인산|ATP]] 생성에 관여하는 반응들을 촉매한다.<ref name=":0">{{서적 인용|title=Fundamentals of Biochemistry Life at the Molecular Level|last=Voet|first=Donald|last2=Voet|first2=Judith|last3=Pratt|first3=Charlotte|publisher=John Wiley & Sons, Inc.|year=2013|isbn=978-1118129180|location=New York City|pages=582–584}}</ref> |
'''미토콘드리아 기질'''({{llang|en|mitochondrial matrix}})은 [[미토콘드리아]]에서 미토콘드리아 안쪽의 공간이다. "기질(基質, matrix)"이라는 단어는 이 공간이 상대적으로 수성(水性)인 [[세포질]]에 비해 점성을 가지고 있다는 사실에서 비롯된 것이다. 미토콘드리아 기질에는 [[미토콘드리아 DNA]], [[리보솜]], 가용성 [[효소]], 작은 유기분자, [[뉴클레오타이드]] [[보조 인자]] 및 [[무기 이온]]이 포함되어 있다.<sup>[1]</sup> 미토콘드리아 기질에 존재하는 효소들은 [[시트르산 회로]], [[산화적 인산화]], [[피루브산의 산화]], [[베타 산화|지방산의 β 산화]]와 같은 [[아데노신 삼인산|ATP]] 생성에 관여하는 반응들을 촉매한다.<ref name=":0">{{서적 인용|title=Fundamentals of Biochemistry Life at the Molecular Level|last=Voet|first=Donald|last2=Voet|first2=Judith|last3=Pratt|first3=Charlotte|publisher=John Wiley & Sons, Inc.|year=2013|isbn=978-1118129180|location=New York City|pages=582–584}}</ref> |
||
구조와 내용물에 기반한 기질의 구성은 [[동화 경로]] 및 [[이화 경로]]가 유리하게 진행될 수 있는 환경을 생성한다. [[미토콘드리아 내막]]의 [[전자전달계]]와 미토콘드리아 기질의 효소는 [[시트르산 회로]]와 [[산화적 인산화]]에서 큰 역할을 한다. 시트르산 회로는 [[산화]]를 통해 [[NADH]]와 [[FADH2|FADH<sub>2</sub>]]를 생성하며, 이는 산화적 인산화에서 환원되어 [[아데노신 삼인산|ATP]]를 생성한다.<ref name=":1">{{Cite book|title=Biochemistry|last1=Stryer|first1=L|last2=Berg|first2=J|last3=Tymoczko|first3=JL|publisher=W.H. Freeman|year=2002|isbn=978-0-7167-4684-3|location=San Francisco|pages=509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773}}</ref><ref>{{Cite journal|last1=Mitchell|first1=Peter|last2=Moyle|first2=Jennifer|date=1967-01-14|title=Chemiosmotic Hypothesis of Oxidative Phosphorylation|journal=Nature|language=en|volume=213|issue=5072|pages=137–139|doi=10.1038/213137a0|pmid=4291593|bibcode=1967Natur.213..137M |s2cid=4149605 }}</ref> |
|||
세포질, [[막 사이 공간]], 구획은 3.8 μL/mg 단백질의 수분 함량을 갖는 반면 미토콘드리아 기질은 0.8 μL/mg 단백질의 수분 함량을 갖는다.<ref name=":5">{{Cite book|title=Distribution of metabolites between mitochondria and cytosol of perfused liver|last1=Soboll|first1=S|last2=Scholz|first2=R|last3=Freisl|first3=M|last4=Elbers|first4=R|last5=Heldt|first5=H.W.|publisher=Elsevier|year=1976|isbn=978-0-444-10925-5|location=New york|pages=29–40}}</ref> 미토콘드리아가 미토콘드리아 내막을 통해 [[삼투]] 균형을 유지하는 방법은 알려져 있지 않지만 미토콘드리아 내막에는 조절된 물 수송을 위한 도관으로 여겨지는 [[아쿠아포린]]이 존재한다. 미토콘드리아 기질의 pH는 약 7.8로 미토콘드리아 막 사이 공간의 pH인 약 7.0~7.4 보다 높다.<ref name=":6">{{Cite journal|last1=Porcelli|first1=Anna Maria|last2=Ghelli|first2=Anna|last3=Zanna|first3=Claudia|last4=Pinton|first4=Paolo|last5=Rizzuto|first5=Rosario|last6=Rugolo|first6=Michela|date=2005-01-28|title=pH difference across the outer mitochondrial membrane measured with a green fluorescent protein mutant|journal=Biochemical and Biophysical Research Communications|volume=326|issue=4|pages=799–804|doi=10.1016/j.bbrc.2004.11.105|pmid=15607740}}</ref> 미토콘드리아 DNA는 1963년에 내쉬(Nash)와 마르기트(Margit)에 의해 발견되었다. 하나에서 다수의 이중 가닥이며, 주로 원형 DNA가 미토콘드리아 기질에 존재한다. [[미토콘드리아 DNA]]는 [[세포]] 전체 [[DNA]]의 1%를 차지한다. 미토콘드리아 DNA는 [[구아닌]]과 [[사이토신]]의 함량이 풍부하다. 포유류의 미토콘드리아에는 55S 리보솜이 존재한다. |
|||
== 구성 == |
|||
=== 대사 산물 === |
|||
미토콘드리아 기질은 미토콘드리아 기질 내의 대사 경로와 관련된 다양한 [[대사 산물]]들을 포함하고 있다. [[시트르산 회로]]는 [[아실-CoA]], [[피루브산]], [[아세틸-CoA]], [[시트르산]], [[아이소시트르산]], [[α-케토글루타르산]], [[석시닐-CoA]], [[푸마르산]], [[석신산]], [[말산]], [[옥살로아세트산]]을 포함한다.<ref name=":1" /> [[요소 회로]]는 [[오르니틴|L-오르니틴]], [[카바모일 인산]], [[시트룰린|L-시트룰린]]을 사용한다.<ref name=":5" /> [[전자전달계]]는 [[조효소]]인 [[NADH]], [[FADH2|FADH<sub>2</sub>]]를 산화시킨다. 단백질 합성은 미토콘드리아 [[DNA]], [[RNA]], [[tRNA]]를 사용한다.<ref name=":6" /> 과정의 조절에는 [[칼슘|Ca<sup>2+</sup>]], [[칼륨|K<sup>+</sup>]], [[마그네슘|Mg<sup>2+</sup>]] 이온이 사용된다.<ref name=":4" /> 이 밖에 미토콘드리아 기질에 존재하는 대사 산물로는 [[이산화 탄소|CO<sub>2</sub>]]<sub>,</sub> [[물|H<sub>2</sub>O]], [[산소|O<sub>2</sub>]]<sub>,</sub> [[아데노신 삼인산|ATP]], [[아데노신 이인산|ADP]], [[무기 인산|P<sub>i</sub>]]가 있다.<ref name=":0" /> |
|||
=== 효소 === |
|||
미토콘드리아 기질에서 일어나는 [[대사 경로]]에 관여하는 다양한 [[효소]]들이 존재한다. [[시트르산 회로]]는 [[피루브산 탈수소효소]], [[시트르산 생성효소]], [[아코니테이스]], [[아이소시트르산 탈수소효소]], [[α-케토글루타르산 탈수소효소]], [[석시닐-CoA 합성효소]], [[푸마레이스]], [[말산 탈수소효소]]에 의해 촉진된다.<ref name=":1" /> 요소 회로는 [[카바모일 인산 합성효소 I]]과 [[오르니틴 카바모일기전이효소]]에 의해 촉진된다.<ref name=":5" /> β-산화는 [[피루브산 카복실화효소]], [[아실-CoA 탈수소효소]], [[β-케토싸이올레이스]]를 사용한다.<ref name=":0" /> 아미노산 생성은 [[아미노기전이효소]]에 의해 촉진된다.<ref name=":7" /> 아미노산 대사는 [[전서열 프로테에이스]]와 같은 [[프로테에이스]]에 의해 매개된다.<ref>{{Cite journal|last1=King|first1=John V.|last2=Liang|first2=Wenguang G.|last3=Scherpelz|first3=Kathryn P.|last4=Schilling|first4=Alexander B.|last5=Meredith|first5=Stephen C.|last6=Tang|first6=Wei-Jen|date=2014-07-08|title=Molecular basis of substrate recognition and degradation by human presequence protease|journal=Structure|volume=22|issue=7|pages=996–1007|doi=10.1016/j.str.2014.05.003|issn=1878-4186|pmc=4128088|pmid=24931469}}</ref> |
|||
=== 미토콘드리아 내막의 구성 요소 === |
|||
미토콘드리아 내막은 산화적 인산화와 관련된 복합체들을 포함하는 [[인지질 이중층]]이다. 이는 미토콘드리아 내막의 [[크리스타]]에서 발견되는 [[전자전달계]]를 포함하며, 4개의 단백질 복합체와 [[ATP 생성효소]]로 구성된다. 이들 복합체는 복합체 I([[NADH:유비퀴논 산화환원효소]]), 복합체 II([[석신산 탈수소효소]]), 복합체 III([[유비퀴논:사이토크롬 c 산화환원효소]]), 복합체 IV([[사이토크롬 c 산화효소]])이다.<ref name=":4" /> |
|||
=== 미토콘드리아 기질의 구성에 대한 미토콘드리아 내막의 조절 === |
|||
전자전달계는 양성자의 능동수송을 통해 ATP의 생성을 촉진하는 pH 및 [[전기화학적 기울기]]를 설정하는 역할을 한다. 전기화학적 기울기는 또한 미토콘드리아 [[막 전위]]에 의해 구동되는 [[칼슘|Ca<sup>2+</sup>]]와 같은 이온의 농도를 조절한다.<ref name=":0" /> 미토콘드리아 내막은 [[CO2|CO<sub>2</sub>]] 및 [[O₂|O<sub>2</sub>]]와 같은 비극성 분자와 [[물|H<sub>2</sub>O]]와 같은 크기가 작은 비전하 극성 분자만 미토콘드리아 기질로 들어갈 수 있도록 한다. 분자는 [[수송 단백질]]과 [[이온 수송체]]를 통해 미토콘드리아 내막을 통과한다. 그런 다음 분자는 [[포린 (단백질)|포린]]을 통해 미토콘드리아로부터 벗어날 수 있다.<ref name=":2">{{Cite book|title=Molecular Biology of the Cell|last1=Alberts|first1=Bruce|last2=Johnson|first2=Alexander|last3=Lewis|first3=julian|last4=Roberts|first4=Keith|last5=Peters|first5=Walter|last6=Raff|first6=Martin|publisher=Garland Publishing Inc|year=1994|isbn=978-0-8153-3218-3|location=New york}}</ref> 이러한 특성은 조절에 필요한 [[이온]] 및 [[대사 산물]]의 농도를 제어하고 ATP 생성 속도를 결정한다.<ref>{{Cite journal|last1=Anderson|first1=S.|last2=Bankier|first2=A. T.|last3=Barrell|first3=B. G.|last4=de Bruijn|first4=M. H. L.|last5=Coulson|first5=A. R.|last6=Drouin|first6=J.|last7=Eperon|first7=I. C.|last8=Nierlich|first8=D. P.|last9=Roe|first9=B. A.|date=1981-04-09|title=Sequence and organization of the human mitochondrial genome|journal=Nature|language=en|volume=290|issue=5806|pages=457–465|doi=10.1038/290457a0|pmid=7219534|bibcode=1981Natur.290..457A |s2cid=4355527 }}</ref><ref name=":3">{{Cite journal|last1=Iuchi|first1=S.|last2=Lin|first2=E. C. C.|date=1993-07-01|title=Adaptation of Escherichia coli to redox environments by gene expression|journal=Molecular Microbiology|language=en|volume=9|issue=1|pages=9–15|doi=10.1111/j.1365-2958.1993.tb01664.x|issn=1365-2958|pmid=8412675|s2cid=39165641 }}</ref> |
|||
== 과정 == |
|||
=== 시트르산 회로 === |
|||
[[해당과정]] 후 [[시트르산 회로]]는 [[아세틸-CoA]]의 생성에 의해 활성화된다. 미토콘드리아 기질에서 [[피루브산 탈수소효소]]에 의한 [[피루브산의 산화]]는 [[이산화 탄소|CO<sub>2</sub>]], [[아세틸-CoA]], [[NADH]]를 생성한다. 지방산의 [[베타 산화|β-산화]]는 아세틸-CoA, NADH 및 [[FADH2|FADH<sub>2</sub>]]를 생성하는 대체 [[이화 경로]] 역할을 한다.<ref name=":0" /> 아세틸-CoA의 생성은 시트르산 회로를 시작하게 하며, 생성된 [[조효소]]는 [[전자전달계]]에서 사용된다.<ref name=":3" /> |
|||
[[파일:Mitochondrial electron transport chain—Etc4.svg|섬네일|미토콘드리아 기질의 관점에서 본 ATP 합성. 이화 경로(시트르산 회로 및 산화적 인산화)와 미토콘드리아 기질의 구조적 구성(지질 이중층 및 전자전달계) 사이의 관계에 의해 생성된 조건은 ATP의 합성을 촉진한다.]] |
|||
[[전자전달계]]의 [[복합체 II]]의 일부이며, [[미토콘드리아 내막]]에 있는 [[석신산 탈수소효소]]를 제외한 시트르산 회로의 모든 [[효소]]들(예: [[시트르산 생성효소]], [[아코니테이스]], [[아이소시트르산 탈수소효소]], [[α-케토글루타르산 탈수소효소]], [[석시닐-CoA 합성효소]], [[푸마레이스]], [[말산 탈수소효소]])은 미토콘드리아 기질에 있다. 시트르산 회로는 탄소의 산화를 통해 NADH와 FADH<sub>2</sub>를 생성한다. [[석시닐-CoA]]는 석시닐-CoA 합성효소에 의해 [[석신산]]으로 전환되며, 이 과정에서 [[구아노신 삼인산|GTP]]가 생성된다.<ref name=":1" /> |
|||
=== 산화적 인산화 === |
|||
[[NADH]]와 [[FADH2|FADH<sub>2</sub>]]는 미토콘드리아 기질에서 생성되거나 포린 및 수송 단백질을 통해 운반되어 산화적 인산화를 통해 산화된다.<ref name=":0" /> NADH와 FADH<sub>2</sub>는 NAD<sup>+</sup>와 FAD를 재생하기 위해 [[전자]]를 전달함으로써 전자전달계에서 산화를 겪는다. 양성자는 전자전달계를 통해 전달되는 전자의 에너지에 의해 미토콘드리아 기질에서 [[막 사이 공간]]으로 [[능동수송]]된다. 4개의 전자가 최종적으로 미토콘드리아 기질의 산소에 의해 수용되어 전자전달계가 완성된다. 양성자는 [[ATP 생성효소]]를 통해 막 사이 공간에서 미토콘드리아 기질로 돌아간다. 이러한 에너지는 양성자의 통과를 촉진하는 ATP 생성효소를 회전시켜 ATP를 생성하는 데 사용된다. 미토콘드리아 기질과 막 사이 공간 사이의 [[수소 이온 농도 지수|pH]] 차이는 ATP 생성효소가 [[양성자]]를 미토콘드리아 기질로 유리하게 통과할 수 있게 하는 [[전기화학적 기울기]]를 생성한다.<ref name=":4">{{Cite journal|last1=Dimroth|first1=P.|last2=Kaim|first2=G.|last3=Matthey|first3=U.|date=2000-01-01|title=Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases|journal=The Journal of Experimental Biology|volume=203|issue=Pt 1|pages=51–59|doi=10.1242/jeb.203.1.51 |issn=0022-0949|pmid=10600673}}</ref> |
|||
=== 요소 회로 === |
|||
[[요소 회로]]의 처음 두 단계는 [[간세포]] 및 신장 세포의 미토콘드리아 기질에서 일어난다. 첫 번째 단계에서 [[암모니아]]는 2개의 ATP 분자의 투자를 통해 [[카바모일 인산]]으로 전환된다. 이 단계에서 [[카바모일 인산 합성효소 I]]에 의해 촉진된다. [[오르니틴 카바모일기전이효소]]에 의해 촉진되는 두 번째 단계는 카바모일 인산과 [[오르니틴]]을 [[시트룰린]]으로 전환시킨다. 이러한 초기 단계 후에 요소 회로는 오르니틴이 수송 통로를 통해 미토콘드리아 기질로 다시 들어가 미토콘드리아 기질 내의 첫 번째 단계를 계속할 때까지 미토콘드리아 내막에서 계속된다.<ref>{{Cite journal|last1=Tuchman|first1=Mendel|last2=Plante|first2=Robert J.|date=1995-01-01|title=Mutations and polymorphisms in the human ornithine transcarbamylase gene: Mutation update addendum|journal=Human Mutation|language=en|volume=5|issue=4|pages=293–295|doi=10.1002/humu.1380050404|issn=1098-1004|pmid=7627182|s2cid=2951786 |doi-access=free}}</ref> |
|||
=== 아미노기 전이반응 === |
|||
[[α-케토글루타르산]]과 [[옥살로아세트산]]은 [[아미노기 전이반응]]을 통해 미토콘드리아 기질 내에서 아미노산으로 전환될 수 있다. 이러한 반응은 옥살로아세트산으로부터 [[아스파르트산]]과 [[아스파라긴]]을 생성하기 위해 아미노기전이효소에 의해 촉진된다. α-케토글루타르산의 아미노기 전이반응은 [[글루탐산]], [[프롤린]] 및 [[아르기닌]]을 생성한다. 그런 다음 이러한 아미노산은 미토콘드리아 기질 내에서 사용되거나 세포질로 운반되어 단백질을 생성하는 데 사용된다.<ref name=":7">{{Cite journal|last1=Karmen|first1=A.|last2=Wroblewski|first2=F.|last3=Ladue|first3=J. S.|date=1955-01-01|title=Transaminase activity in human blood|journal=The Journal of Clinical Investigation|volume=34|issue=1|pages=126–131|doi=10.1172/JCI103055|issn=0021-9738|pmc=438594|pmid=13221663}}</ref><ref>{{Cite journal|last1=Kirsch|first1=Jack F.|last2=Eichele|first2=Gregor|last3=Ford|first3=Geoffrey C.|last4=Vincent|first4=Michael G.|last5=Jansonius|first5=Johan N.|author-link5=Johan Jansonius|last6=Gehring|first6=Heinz|last7=Christen|first7=Philipp|date=1984-04-15|title=Mechanism of action of aspartate aminotransferase proposed on the basis of its spatial structure|journal=Journal of Molecular Biology|volume=174|issue=3|pages=497–525|doi=10.1016/0022-2836(84)90333-4|pmid=6143829}}</ref> |
|||
=== 조절 === |
|||
미토콘드리아 기질 내에서의 조절은 주로 이온의 농도, 대사산물의 농도 및 에너지 충전에 의해 제어된다. [[칼슘|Ca<sup>2+</sup>]]와 같은 이온의 이용 가능성은 미토콘드리아 기질에서 시트르산 회로의 다양한 기능을 제어하여 회로에서 반응 속도를 증가시키는 [[피루브산 탈수소효소]], [[아이소시트르산 탈수소효소]] 및 [[α-케토글루타르산 탈수소효소]]를 활성화시킨다.<ref>{{Cite journal|last1=Denton|first1=Richard M.|last2=Randle|first2=Philip J.|last3=Bridges|first3=Barbara J.|last4=Cooper|first4=Ronald H.|last5=Kerbey|first5=Alan L.|last6=Pask|first6=Helen T.|last7=Severson|first7=David L.|last8=Stansbie|first8=David|last9=Whitehouse|first9=Susan|date=1975-10-01|title=Regulation of mammalian pyruvate dehydrogenase|journal=Molecular and Cellular Biochemistry|language=en|volume=9|issue=1|pages=27–53|doi=10.1007/BF01731731|issn=0300-8177|pmid=171557|s2cid=27367543 }}</ref> 미토콘드리아 기질에서 대사 중간생성물과 조효소의 농도는 대사 중간생성물을 [[보충대사 반응|보충하는]](anaplerotic) 효과 및 대사 중간생성물을 제거하는(cataplerotic) 효과로 인해 ATP의 생성 속도를 증가시키거나 감소시킨다. NADH는 [[α-케토글루타르산 탈수소효소]], [[아이소시트르산 탈수소효소]], [[시트르산 생성효소]], [[피루브산 탈수소효소]]에 대한 [[효소 저해제|저해제]]로 작용할 수 있다. 특히 옥살로아세트산의 농도는 낮게 유지되기 때문에 이 농도의 변화는 시트르산 회로를 촉진하는 역할을 한다.<ref name=":1" /> ATP의 생성은 또한 아이소시트르산 탈수소효소, 피루브산 탈수소효소, 전자전달계의 복합체 및 ATP 생성효소에 대한 저해제로 작용하여 조절의 수단으로도 사용된다. ADP는 [[효소 활성화제|활성화제]]로 작용한다.<ref name=":0" /> |
|||
=== 단백질 합성 === |
|||
미토콘드리아는 전자전달계에서 발견되는 단백질을 생성하는 데 사용되는 자체 DNA 세트를 포함한다. 미토콘드리아 DNA는 미토콘드리아 전사체, [[리보솜 단백질]], [[리보솜 RNA]], [[운반 RNA]] 및 전자전달계의 [[단백질 복합체|복합체]]에서 발견되는 [[단백질 소단위체]]와 관련된 약 13가지의 단백질을 암호화하고 있다.<ref>{{Cite journal|last=Fox|first=Thomas D.|date=2012-12-01|title=Mitochondrial Protein Synthesis, Import, and Assembly|journal=Genetics|volume=192|issue=4|pages=1203–1234|doi=10.1534/genetics.112.141267|issn=0016-6731|pmc=3512135|pmid=23212899}}</ref><ref>{{Cite journal|last1=Grivell|first1=L.A.|last2=Pel|first2=H.J.|year=1994|title=Protein synthesis in mitochondria|url=https://pure.uva.nl/ws/files/2967481/358_4203y.pdf|journal=Mol. Biol. Rep.|volume=19|issue=3|doi=10.1007/bf00986960|pages=183–194|pmid=7969106 |s2cid=21200502 }}</ref> |
|||
== 같이 보기 == |
== 같이 보기 == |
||
* [[바탕질]] (기질) |
|||
* [[미토콘드리아]] |
* [[미토콘드리아]] |
||
* [[미토콘드리아 내막]] |
* [[미토콘드리아 내막]] |
||
* [[미토콘드리아 DNA]] |
|||
== 각주 == |
== 각주 == |
||
2023년 4월 19일 (수) 13:50 판
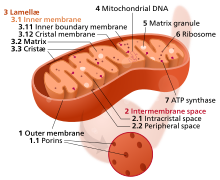
미토콘드리아 기질(영어: mitochondrial matrix)은 미토콘드리아에서 미토콘드리아 안쪽의 공간이다. "기질(基質, matrix)"이라는 단어는 이 공간이 상대적으로 수성(水性)인 세포질에 비해 점성을 가지고 있다는 사실에서 비롯된 것이다. 미토콘드리아 기질에는 미토콘드리아 DNA, 리보솜, 가용성 효소, 작은 유기분자, 뉴클레오타이드 보조 인자 및 무기 이온이 포함되어 있다.[1] 미토콘드리아 기질에 존재하는 효소들은 시트르산 회로, 산화적 인산화, 피루브산의 산화, 지방산의 β 산화와 같은 ATP 생성에 관여하는 반응들을 촉매한다.[1]
구조와 내용물에 기반한 기질의 구성은 동화 경로 및 이화 경로가 유리하게 진행될 수 있는 환경을 생성한다. 미토콘드리아 내막의 전자전달계와 미토콘드리아 기질의 효소는 시트르산 회로와 산화적 인산화에서 큰 역할을 한다. 시트르산 회로는 산화를 통해 NADH와 FADH2를 생성하며, 이는 산화적 인산화에서 환원되어 ATP를 생성한다.[2][3]
세포질, 막 사이 공간, 구획은 3.8 μL/mg 단백질의 수분 함량을 갖는 반면 미토콘드리아 기질은 0.8 μL/mg 단백질의 수분 함량을 갖는다.[4] 미토콘드리아가 미토콘드리아 내막을 통해 삼투 균형을 유지하는 방법은 알려져 있지 않지만 미토콘드리아 내막에는 조절된 물 수송을 위한 도관으로 여겨지는 아쿠아포린이 존재한다. 미토콘드리아 기질의 pH는 약 7.8로 미토콘드리아 막 사이 공간의 pH인 약 7.0~7.4 보다 높다.[5] 미토콘드리아 DNA는 1963년에 내쉬(Nash)와 마르기트(Margit)에 의해 발견되었다. 하나에서 다수의 이중 가닥이며, 주로 원형 DNA가 미토콘드리아 기질에 존재한다. 미토콘드리아 DNA는 세포 전체 DNA의 1%를 차지한다. 미토콘드리아 DNA는 구아닌과 사이토신의 함량이 풍부하다. 포유류의 미토콘드리아에는 55S 리보솜이 존재한다.
구성
대사 산물
미토콘드리아 기질은 미토콘드리아 기질 내의 대사 경로와 관련된 다양한 대사 산물들을 포함하고 있다. 시트르산 회로는 아실-CoA, 피루브산, 아세틸-CoA, 시트르산, 아이소시트르산, α-케토글루타르산, 석시닐-CoA, 푸마르산, 석신산, 말산, 옥살로아세트산을 포함한다.[2] 요소 회로는 L-오르니틴, 카바모일 인산, L-시트룰린을 사용한다.[4] 전자전달계는 조효소인 NADH, FADH2를 산화시킨다. 단백질 합성은 미토콘드리아 DNA, RNA, tRNA를 사용한다.[5] 과정의 조절에는 Ca2+, K+, Mg2+ 이온이 사용된다.[6] 이 밖에 미토콘드리아 기질에 존재하는 대사 산물로는 CO2, H2O, O2, ATP, ADP, Pi가 있다.[1]
효소
미토콘드리아 기질에서 일어나는 대사 경로에 관여하는 다양한 효소들이 존재한다. 시트르산 회로는 피루브산 탈수소효소, 시트르산 생성효소, 아코니테이스, 아이소시트르산 탈수소효소, α-케토글루타르산 탈수소효소, 석시닐-CoA 합성효소, 푸마레이스, 말산 탈수소효소에 의해 촉진된다.[2] 요소 회로는 카바모일 인산 합성효소 I과 오르니틴 카바모일기전이효소에 의해 촉진된다.[4] β-산화는 피루브산 카복실화효소, 아실-CoA 탈수소효소, β-케토싸이올레이스를 사용한다.[1] 아미노산 생성은 아미노기전이효소에 의해 촉진된다.[7] 아미노산 대사는 전서열 프로테에이스와 같은 프로테에이스에 의해 매개된다.[8]
미토콘드리아 내막의 구성 요소
미토콘드리아 내막은 산화적 인산화와 관련된 복합체들을 포함하는 인지질 이중층이다. 이는 미토콘드리아 내막의 크리스타에서 발견되는 전자전달계를 포함하며, 4개의 단백질 복합체와 ATP 생성효소로 구성된다. 이들 복합체는 복합체 I(NADH:유비퀴논 산화환원효소), 복합체 II(석신산 탈수소효소), 복합체 III(유비퀴논:사이토크롬 c 산화환원효소), 복합체 IV(사이토크롬 c 산화효소)이다.[6]
미토콘드리아 기질의 구성에 대한 미토콘드리아 내막의 조절
전자전달계는 양성자의 능동수송을 통해 ATP의 생성을 촉진하는 pH 및 전기화학적 기울기를 설정하는 역할을 한다. 전기화학적 기울기는 또한 미토콘드리아 막 전위에 의해 구동되는 Ca2+와 같은 이온의 농도를 조절한다.[1] 미토콘드리아 내막은 CO2 및 O2와 같은 비극성 분자와 H2O와 같은 크기가 작은 비전하 극성 분자만 미토콘드리아 기질로 들어갈 수 있도록 한다. 분자는 수송 단백질과 이온 수송체를 통해 미토콘드리아 내막을 통과한다. 그런 다음 분자는 포린을 통해 미토콘드리아로부터 벗어날 수 있다.[9] 이러한 특성은 조절에 필요한 이온 및 대사 산물의 농도를 제어하고 ATP 생성 속도를 결정한다.[10][11]
과정
시트르산 회로
해당과정 후 시트르산 회로는 아세틸-CoA의 생성에 의해 활성화된다. 미토콘드리아 기질에서 피루브산 탈수소효소에 의한 피루브산의 산화는 CO2, 아세틸-CoA, NADH를 생성한다. 지방산의 β-산화는 아세틸-CoA, NADH 및 FADH2를 생성하는 대체 이화 경로 역할을 한다.[1] 아세틸-CoA의 생성은 시트르산 회로를 시작하게 하며, 생성된 조효소는 전자전달계에서 사용된다.[11]
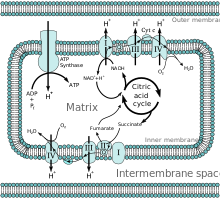
전자전달계의 복합체 II의 일부이며, 미토콘드리아 내막에 있는 석신산 탈수소효소를 제외한 시트르산 회로의 모든 효소들(예: 시트르산 생성효소, 아코니테이스, 아이소시트르산 탈수소효소, α-케토글루타르산 탈수소효소, 석시닐-CoA 합성효소, 푸마레이스, 말산 탈수소효소)은 미토콘드리아 기질에 있다. 시트르산 회로는 탄소의 산화를 통해 NADH와 FADH2를 생성한다. 석시닐-CoA는 석시닐-CoA 합성효소에 의해 석신산으로 전환되며, 이 과정에서 GTP가 생성된다.[2]
산화적 인산화
NADH와 FADH2는 미토콘드리아 기질에서 생성되거나 포린 및 수송 단백질을 통해 운반되어 산화적 인산화를 통해 산화된다.[1] NADH와 FADH2는 NAD+와 FAD를 재생하기 위해 전자를 전달함으로써 전자전달계에서 산화를 겪는다. 양성자는 전자전달계를 통해 전달되는 전자의 에너지에 의해 미토콘드리아 기질에서 막 사이 공간으로 능동수송된다. 4개의 전자가 최종적으로 미토콘드리아 기질의 산소에 의해 수용되어 전자전달계가 완성된다. 양성자는 ATP 생성효소를 통해 막 사이 공간에서 미토콘드리아 기질로 돌아간다. 이러한 에너지는 양성자의 통과를 촉진하는 ATP 생성효소를 회전시켜 ATP를 생성하는 데 사용된다. 미토콘드리아 기질과 막 사이 공간 사이의 pH 차이는 ATP 생성효소가 양성자를 미토콘드리아 기질로 유리하게 통과할 수 있게 하는 전기화학적 기울기를 생성한다.[6]
요소 회로
요소 회로의 처음 두 단계는 간세포 및 신장 세포의 미토콘드리아 기질에서 일어난다. 첫 번째 단계에서 암모니아는 2개의 ATP 분자의 투자를 통해 카바모일 인산으로 전환된다. 이 단계에서 카바모일 인산 합성효소 I에 의해 촉진된다. 오르니틴 카바모일기전이효소에 의해 촉진되는 두 번째 단계는 카바모일 인산과 오르니틴을 시트룰린으로 전환시킨다. 이러한 초기 단계 후에 요소 회로는 오르니틴이 수송 통로를 통해 미토콘드리아 기질로 다시 들어가 미토콘드리아 기질 내의 첫 번째 단계를 계속할 때까지 미토콘드리아 내막에서 계속된다.[12]
아미노기 전이반응
α-케토글루타르산과 옥살로아세트산은 아미노기 전이반응을 통해 미토콘드리아 기질 내에서 아미노산으로 전환될 수 있다. 이러한 반응은 옥살로아세트산으로부터 아스파르트산과 아스파라긴을 생성하기 위해 아미노기전이효소에 의해 촉진된다. α-케토글루타르산의 아미노기 전이반응은 글루탐산, 프롤린 및 아르기닌을 생성한다. 그런 다음 이러한 아미노산은 미토콘드리아 기질 내에서 사용되거나 세포질로 운반되어 단백질을 생성하는 데 사용된다.[7][13]
조절
미토콘드리아 기질 내에서의 조절은 주로 이온의 농도, 대사산물의 농도 및 에너지 충전에 의해 제어된다. Ca2+와 같은 이온의 이용 가능성은 미토콘드리아 기질에서 시트르산 회로의 다양한 기능을 제어하여 회로에서 반응 속도를 증가시키는 피루브산 탈수소효소, 아이소시트르산 탈수소효소 및 α-케토글루타르산 탈수소효소를 활성화시킨다.[14] 미토콘드리아 기질에서 대사 중간생성물과 조효소의 농도는 대사 중간생성물을 보충하는(anaplerotic) 효과 및 대사 중간생성물을 제거하는(cataplerotic) 효과로 인해 ATP의 생성 속도를 증가시키거나 감소시킨다. NADH는 α-케토글루타르산 탈수소효소, 아이소시트르산 탈수소효소, 시트르산 생성효소, 피루브산 탈수소효소에 대한 저해제로 작용할 수 있다. 특히 옥살로아세트산의 농도는 낮게 유지되기 때문에 이 농도의 변화는 시트르산 회로를 촉진하는 역할을 한다.[2] ATP의 생성은 또한 아이소시트르산 탈수소효소, 피루브산 탈수소효소, 전자전달계의 복합체 및 ATP 생성효소에 대한 저해제로 작용하여 조절의 수단으로도 사용된다. ADP는 활성화제로 작용한다.[1]
단백질 합성
미토콘드리아는 전자전달계에서 발견되는 단백질을 생성하는 데 사용되는 자체 DNA 세트를 포함한다. 미토콘드리아 DNA는 미토콘드리아 전사체, 리보솜 단백질, 리보솜 RNA, 운반 RNA 및 전자전달계의 복합체에서 발견되는 단백질 소단위체와 관련된 약 13가지의 단백질을 암호화하고 있다.[15][16]
같이 보기
- 바탕질 (기질)
- 미토콘드리아
- 미토콘드리아 내막
- 미토콘드리아 DNA
각주
- ↑ 가 나 다 라 마 바 사 Voet, Donald; Voet, Judith; Pratt, Charlotte (2013). 《Fundamentals of Biochemistry Life at the Molecular Level》. New York City: John Wiley & Sons, Inc. 582–584쪽. ISBN 978-1118129180.
- ↑ 가 나 다 라 마 Stryer, L; Berg, J; Tymoczko, JL (2002). 《Biochemistry》. San Francisco: W.H. Freeman. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773쪽. ISBN 978-0-7167-4684-3.
- ↑ Mitchell, Peter; Moyle, Jennifer (1967년 1월 14일). “Chemiosmotic Hypothesis of Oxidative Phosphorylation”. 《Nature》 (영어) 213 (5072): 137–139. Bibcode:1967Natur.213..137M. doi:10.1038/213137a0. PMID 4291593. S2CID 4149605.
- ↑ 가 나 다 Soboll, S; Scholz, R; Freisl, M; Elbers, R; Heldt, H.W. (1976). 《Distribution of metabolites between mitochondria and cytosol of perfused liver》. New york: Elsevier. 29–40쪽. ISBN 978-0-444-10925-5.
- ↑ 가 나 Porcelli, Anna Maria; Ghelli, Anna; Zanna, Claudia; Pinton, Paolo; Rizzuto, Rosario; Rugolo, Michela (2005년 1월 28일). “pH difference across the outer mitochondrial membrane measured with a green fluorescent protein mutant”. 《Biochemical and Biophysical Research Communications》 326 (4): 799–804. doi:10.1016/j.bbrc.2004.11.105. PMID 15607740.
- ↑ 가 나 다 Dimroth, P.; Kaim, G.; Matthey, U. (2000년 1월 1일). “Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases”. 《The Journal of Experimental Biology》 203 (Pt 1): 51–59. doi:10.1242/jeb.203.1.51. ISSN 0022-0949. PMID 10600673.
- ↑ 가 나 Karmen, A.; Wroblewski, F.; Ladue, J. S. (1955년 1월 1일). “Transaminase activity in human blood”. 《The Journal of Clinical Investigation》 34 (1): 126–131. doi:10.1172/JCI103055. ISSN 0021-9738. PMC 438594. PMID 13221663.
- ↑ King, John V.; Liang, Wenguang G.; Scherpelz, Kathryn P.; Schilling, Alexander B.; Meredith, Stephen C.; Tang, Wei-Jen (2014년 7월 8일). “Molecular basis of substrate recognition and degradation by human presequence protease”. 《Structure》 22 (7): 996–1007. doi:10.1016/j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, julian; Roberts, Keith; Peters, Walter; Raff, Martin (1994). 《Molecular Biology of the Cell》. New york: Garland Publishing Inc. ISBN 978-0-8153-3218-3.
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (1981년 4월 9일). “Sequence and organization of the human mitochondrial genome”. 《Nature》 (영어) 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534. S2CID 4355527.
- ↑ 가 나 Iuchi, S.; Lin, E. C. C. (1993년 7월 1일). “Adaptation of Escherichia coli to redox environments by gene expression”. 《Molecular Microbiology》 (영어) 9 (1): 9–15. doi:10.1111/j.1365-2958.1993.tb01664.x. ISSN 1365-2958. PMID 8412675. S2CID 39165641.
- ↑ Tuchman, Mendel; Plante, Robert J. (1995년 1월 1일). “Mutations and polymorphisms in the human ornithine transcarbamylase gene: Mutation update addendum”. 《Human Mutation》 (영어) 5 (4): 293–295. doi:10.1002/humu.1380050404. ISSN 1098-1004. PMID 7627182. S2CID 2951786.
- ↑ Kirsch, Jack F.; Eichele, Gregor; Ford, Geoffrey C.; Vincent, Michael G.; Jansonius, Johan N.; Gehring, Heinz; Christen, Philipp (1984년 4월 15일). “Mechanism of action of aspartate aminotransferase proposed on the basis of its spatial structure”. 《Journal of Molecular Biology》 174 (3): 497–525. doi:10.1016/0022-2836(84)90333-4. PMID 6143829.
- ↑ Denton, Richard M.; Randle, Philip J.; Bridges, Barbara J.; Cooper, Ronald H.; Kerbey, Alan L.; Pask, Helen T.; Severson, David L.; Stansbie, David; Whitehouse, Susan (1975년 10월 1일). “Regulation of mammalian pyruvate dehydrogenase”. 《Molecular and Cellular Biochemistry》 (영어) 9 (1): 27–53. doi:10.1007/BF01731731. ISSN 0300-8177. PMID 171557. S2CID 27367543.
- ↑ Fox, Thomas D. (2012년 12월 1일). “Mitochondrial Protein Synthesis, Import, and Assembly”. 《Genetics》 192 (4): 1203–1234. doi:10.1534/genetics.112.141267. ISSN 0016-6731. PMC 3512135. PMID 23212899.
- ↑ Grivell, L.A.; Pel, H.J. (1994). “Protein synthesis in mitochondria” (PDF). 《Mol. Biol. Rep.》 19 (3): 183–194. doi:10.1007/bf00986960. PMID 7969106. S2CID 21200502.
