아미노산: 두 판 사이의 차이
편집 요약 없음 |
잔글 . |
||
| 1번째 줄: | 1번째 줄: | ||
'''아미노산'''([[영어]]: amino acid)은 생물의 몸을 구성하는 [[단백질]]의 기본 구성단위이다. 단백질을 완전히 [[가수분해]]하면 암모니아와 아미노산이 생성되는데, 아미노산은 [[아미노기]]와 [[카복시기]]를 포함한 모든 분자를 지칭한다. 화학식은 [[아미노기|NH<sub>2</sub>]][[탄소|C]][[수소|H]][[알킬기|R<sub>n</sub>]][[카복실기|COOH]](단, n=1~20)이다 |
'''아미노산'''([[영어]]: amino acid)은 생물의 몸을 구성하는 [[단백질]]의 기본 구성단위이다. 단백질을 완전히 [[가수분해]]하면 암모니아와 아미노산이 생성되는데, 아미노산은 [[아미노기]]와 [[카복시기]]를 포함한 모든 분자를 지칭한다. 화학식은 [[아미노기|NH<sub>2</sub>]][[탄소|C]][[수소|H]][[알킬기|R<sub>n</sub>]][[카복실기|COOH]](단, n=1~20)이다. |
||
[[생화학]]에선 흔히 α-아미노산을 간단히 '''아미노산'''이라 부른다. α-아미노산은 아미노기와 카복시기가 하나의 탄소(α-탄소라 부른다.)에 붙어있다. [[프롤린]](proline)은 실제로는 아미노기를 포함하지 않기 때문에, 엄밀하게 말해서 아미노산이 아니라, '이미노산'(imino acid)이다. 그러나, 생화학적으로 다른 진짜 아미노산과 비슷한 기능을 수행하기 때문에, 아미노산으로 분류한다. |
[[생화학]]에선 흔히 α-아미노산을 간단히 '''아미노산'''이라 부른다. α-아미노산은 아미노기와 카복시기가 하나의 탄소(α-탄소라 부른다.)에 붙어있다. [[프롤린]](proline)은 실제로는 아미노기를 포함하지 않기 때문에, 엄밀하게 말해서 아미노산이 아니라, '이미노산'(imino acid)이다. 그러나, 생화학적으로 다른 진짜 아미노산과 비슷한 기능을 수행하기 때문에, 아미노산으로 분류한다. |
||
2019년 9월 15일 (일) 10:52 판
아미노산(영어: amino acid)은 생물의 몸을 구성하는 단백질의 기본 구성단위이다. 단백질을 완전히 가수분해하면 암모니아와 아미노산이 생성되는데, 아미노산은 아미노기와 카복시기를 포함한 모든 분자를 지칭한다. 화학식은 NH2CHRnCOOH(단, n=1~20)이다.
생화학에선 흔히 α-아미노산을 간단히 아미노산이라 부른다. α-아미노산은 아미노기와 카복시기가 하나의 탄소(α-탄소라 부른다.)에 붙어있다. 프롤린(proline)은 실제로는 아미노기를 포함하지 않기 때문에, 엄밀하게 말해서 아미노산이 아니라, '이미노산'(imino acid)이다. 그러나, 생화학적으로 다른 진짜 아미노산과 비슷한 기능을 수행하기 때문에, 아미노산으로 분류한다.
구조
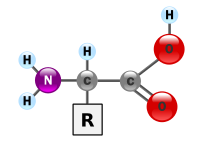
일반적인 α-아미노산의 구조는 오른쪽 그림과 같다.
아미노기와 카복시기를 모두 포함하고 있어, 아미노산은 중성에서 쯔비터 이온(또는 양극성 이온이라고도 함.)으로 존재하며, 공명 안정화를 취한다.
여기서 "R"은 나머지라는 뜻의 "Residue" 혹은 "Remainder"의 머릿글자로 곁사슬(side chain)을 나타내고, 곁사슬에 따라 무슨 아미노산인지가 결정된다. 아미노산은 곁사슬의 성질에 따라 산성, 염기성, 친수성(극성), 소수성(비극성)의 네 가지 종류로 구분된다.
곁사슬 수소원자뿐인 글라이신(glycine)을 제외하고, 다른 아미노산은 모두 두가지 광학 활성을 가져, D형과 L형으로 구분된다. 단백질(protein)을 구성하는 아미노산의 거의 대부분은 L-아미노산 형태로 존재한다. 청자고둥(cone snail)같은 일부 특이한 바다생물에서 D-아미노산이 발견되기도 했다. 단백질은 아미노산의 축합중합을 통해 만들어진다.
종류
외부 링크
- 네이버 캐스트 - 아미노산
 위키미디어 공용에 아미노산 관련 미디어 자료가 있습니다.
위키미디어 공용에 아미노산 관련 미디어 자료가 있습니다.
| 이 글은 과학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
