위치표시자
위치표시자(位置表示子, 영어: locant)는 유기화학의 명명법에서 분자 내의 작용기 또는 치환기의 위치를 나타내는 용어이다.[1]
숫자 위치표시자[편집]
국제 순수·응용 화학 연합(IUPAC)은 일반적으로 모체 탄화수소 사슬을 식별하고 우선 순위에 따라 치환기를 기반으로 탄소 원자에 번호를 할당함으로써 치환기의 위치를 나타내기 위해 숫자 접두사를 사용할 것을 권장한다. 예를 들어 정확히 5개의 탄소 원자 사슬을 포함하는 케톤인 펜탄온의 선형 형태에는 적어도 2가지 이성질체가 있다. 중간의 3개의 탄소 중 하나와 결합한 산소 원자가 있지만(말단 탄소와 결합한 경우 분자는 케톤이 아니라 알데하이드가 된다) 그것이 어디에 위치하는지는 명확하지 않다.
이 예에서 탄소 원자는 1에서 5까지 번호가 매겨져 있으며 한 쪽 끝에서 시작하여 사슬을 따라 순차적으로 번호가 부여된다. 이제 산소 원자의 위치는 탄소 원자 번호인 2, 3 또는 4로 정의할 수 있다. 그러나 2번 탄소와 4번 탄소는 정확히 동일하다. 이는 분자를 180도 회전하여 나타낼 수 있다.
위치표시자는 산소 원자가 결합된 탄소 원자의 번호이다. 산소가 중간 탄소에 결합되어 있으면 위치표시자는 3이다. 산소가 한 쪽(말단 탄소에 인접한)의 원자에 결합되어 있으면 위치표시자는 2 또는 4이다. 여기서 선택이 주어지면 탄소가 정확히 동일한 경우 항상 더 낮은 숫자가 선택된다. 따라서 위치 표시자는 이 분자에서 2 또는 3이다.
위치표시자는 모호성을 제거하기 위해 분자의 이름에 통합된다. 따라서 분자는 산소 원자의 위치에 따라 펜탄-2-온 또는 펜탄-3-온으로 명명된다.
산소 대신에 모든 곁사슬이 존재할 수 있으며 수소 이외의 것이 부착된 탄소의 숫자로 간단히 정의할 수 있다.
그리스 문자 위치표시자[편집]


또 다른 일반적인 체계는 그리스 문자 접두사를 위치표시자로 사용하는 데, 이는 다른 작용기에 대한 수소 원자뿐만 아니라 탄소 원자의 상대적인 위치를 식별하는 데 유용하다.
α-탄소(영어: α-carbon)는 카보닐기와 같은 작용기에 부착되는 첫 번째 탄소 원자를 지칭한다. 두 번째 탄소 원자는 β-탄소(영어: β-carbon), 세 번째 탄소 원자는 γ-탄소(영어: γ-carbon)라고 하며, 명명 체계는 그리스 알파벳 순서로 계속된다.[2]
이러한 명명법은 탄소 원자에 부착되는 수소 원자에도 적용할 수 있다. α-탄소에 붙어 있는 수소 원자를 α-수소(영어: α-hydrogen)라고 하고, β-탄소에 붙어 있는 수소 원자를 β-수소(영어: β-hydrogen)라고 하는 식이다.
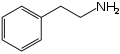
하나 이상의 작용기를 가지고 있는 유기 분자는 혼동의 원인을 제공할 수 있다. 일반적으로 분자의 이름 또는 유형과 관련된 작용기는 탄소 원자의 명명을 위한 "참고" 작용기이다. 예를 들어 나이트로스타이렌과 펜에틸아민 분자는 매우 유사하다. 나이트로스타이렌은 펜에틸아민으로 환원될 수 있다. 그러나 나이트로스타이렌의 α-탄소 원자는 페닐기에 인접해 있다. 펜에틸아민에서 이것과 동일한 탄소 원자는 β-탄소 원자이며, 펜에틸아민(스타이렌이 아닌 아민임)은 분자의 반대쪽 "끝"에서부터 원자를 계산한다.[3]
-
나이트로스타이렌의 구조
-
펜에틸아민의 구조
단백질과 아미노산[편집]
단백질과 아미노산에서 α-탄소는 분자 내 카보닐 탄소 원자 앞에 위치한 골격의 탄소이다. 따라서 일반적인 단백질의 골격을 따라 읽으면 –[N—Cα—카보닐 C]n– 등의 서열(N 말단에서 C 말단 방향으로 읽을 때)이 된다. α-탄소는 서로 다른 치환기가 각각의 서로 다른 아미노산에 부착되는 부위이다. 즉, α-탄소에 부착되는 곁사슬의 종류가 아미노산의 다양성을 부여하는 것이다. 곁사슬은 글리신을 제외한 모든 아미노산에 대해 α-탄소에 입체발생적 특성을 부여한다. 따라서 α-탄소는 글리신을 제외한 모든 아미노산에서 입체중심이다. 글리신에는 β-탄소가 없지만, 다른 모든 아미노산에는 β-탄소가 있다.
아미노산의 α-탄소는 단백질의 접힘에 중요하다. 아미노산의 사슬인 단백질을 설명할 때 각 아미노산의 위치를 α-탄소의 위치로 근사하는 경우가 많다. 일반적으로 단백질에서 인접한 아미노산의 α-탄소는 약 3.8 Å (380 피코미터) 떨어져 있다.
엔올과 엔올레이트[편집]
α-탄소는 엔올 및 엔올레이트 기반의 카보닐 화학에서도 중요하다. 엔올레이트 또는 엔올로의 전환에 의해 영향을 받는 화학적 변환은 일반적으로 α-탄소가 친핵체로 작용하는 데 예를 들어 1차 할로알케인의 존재 하에서 알킬화되도록 한다. 예외는 실릴 염화물, 실릴 브로민화물, 실릴 아이오딘화물과의 반응인데, 여기서 산소는 친핵체로 작용하여 실릴 엔올 에터를 생성한다.
같이 보기[편집]
각주[편집]
- ↑ 《Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013.》 (PDF). London: International Union of Pure and Applied Chemistry. ISBN 978-0-85404-182-4. 2022년 12월 14일에 확인함.
- ↑ 《Hackh's Chemical Dictionary》. 1969. 95쪽.
- ↑ “Nomenclature”. 《Ask Dr. Shulgin Online》. 2010년 8월 5일에 확인함.