블루 화이트 스크린
이 문서는 영어 위키백과의 Blue–white screen 문서를 번역하여 문서의 내용을 확장할 필요가 있습니다. |
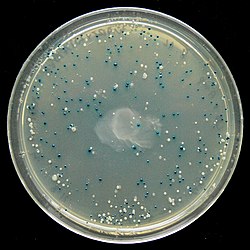
블루 화이트 스크린(Blue–white screen)은 스크리닝 기술로 벡터의 성공적인 DNA접합을 검출하는 기술이다. 관심있는 DNA가 벡터에 들어가면 벡터는 형질전환되어 수용성세포(受容性細胞, competent cell)(박테리아)에 들어간다. 수용성세포들은 X-gal이 있는 평판에서 자라난다. 만약 접합이 성공적이라면, 박테리아 콜로니는 흰색이 될 것이고, 성공적이지 않다면, 파란색이 될 것이다. 이 기술은 DNA접합을 검출하는데 있어서 빠르고 쉬운 기술이다.
배경지식
[편집]분자복제는 분자생물학에 있어서 가장 흔하게 사용되는 기술이다. 관심있는 유전자는 DNA접합을 통해 플라스미드 벡터에 삽입된다. 그리고 플라스미드는 E.coli세포에 형질전환된다. 그러나, 모든 세포들에 관심있는 유전자가 삽입된 플라스미드가 들어가는 것은 아니다. 그리고 하나씩 콜로니에서 플라스미드가 들어갔는지 확인하는 것은 시간이 많이 걸린다. 그래서 초기의 방법들 중 하나가 blue white screening 의 방법이다. 이 기술을 통해 박테리아 콜로니의 색을 통해 반응을 알아볼 수 있다.
이 방법은 β-galactosidase의 유전자에 α-complementation(상보성)에 기반한다. α-complementation의 현상은 François Jacob과 Jacques Monod의 실험실에서 처음 발견되었는데, 그들은 유전자가 지워진 돌연변이로 작동하지 않는 β-galactosidase가 β-galactosidase와 같은 서열을 가진 α-donor peptide로부터 작동이 살아난 것을 보았다.[1] Langley et al. β-galactosidase가 작동하지 않는 돌연변이는 N-말단 잔기의 11-41이 삭제되어있다. β-galactosidase가 작동하려면 3-90 잔기들에 의해 펩티드가 만들어져야한다.[2] 145개의 아미노산을 코딩하는 M13사상파지(filamentous phage)가 만들어졌고 Messing et al., X-gal을 포함한 평판에서, 파지에 감염되어 작동하지 않는 단백질을 포함한 세포들은 파란 플라크를 만든다.[3]
pUC 플라스미드 복제 벡터는 M13 시스템으로부터 개발되었고, 스크리닝 방법에 처음으로 득을 본 플라스미드이다.[4] 이 방법에서 DNA는 플라스미드로 접합이 되고, α peptide를 방해한다. 그래서 기능을 하는 β-galactosidase 가 만들어질 수 없다. 플라스미드를 포함한 형질전환된 세포들은 그러므로 흰색 콜로니를 만들고, 형질전환되지 않은 세포들은 파란 콜로니를 만든다.
분자생물학적 기작
[편집]
β-galactosidase는 lacZ유전자로부터 단백질 암호화된 것으로 Lac오페론의 일부이다. β-galactosidase는 활성화 상태에서 homotetramer로 존재한다. 그러나, M15 균주로부터 나온 E. coli 돌연변이 β-galactosidase는 N-말단의 11-41잔기가 삭제되었고, 이 돌연변이체의 ω-peptide는 사량체(tetramer) 형성할 수 없기에 불활성상태이다. 그러나 α-peptide가 있는 상태에서 온전한 활성화 사량체로 전환될 수 있다. 이렇게 α-peptide가 돌연변이 β-galactosidase의 기능을 살리는 것을 "α-complementation" 이라 부른다.
이 방법으로, 숙주 E. coli균주는 lacZ가 삭제되어 ω-peptide를 만드는 돌연변이(lacZΔM15)를 가지고 다닌다. 플라스미드는 lacZα를 가지고 다니는데, β-galactosidase의 처음 59잔기를 암호화하는 서열이 포함되는 α-peptide이다. 돌연변이 E. coli와 플라스미드 모두 홀로 작용할 수 없다. 그러나, 두개의 단백질들이 함께 발현되면, 플라스미드의 lacZα 서열이 lacZΔM15로 형질전환되어 세포로 들어가게되면, 그들은 기능을 하는 β-galactosidase 효소를 만들 수 있다.
blue white screen 방법은 이 α-complementation 과정을 방해하는 것이다. 플라스미드는 다복제구역 (multiple cloning site, MCS)에 lacZα서열을 들고다닌다. MCS안의 lacZα 서열은 제한효소로 잘릴 수 있으며, 외부 DNA가 들어 갈 수 있어서 기능을 하지 않는 β-galactosidase가 형성 될 수 있다.
활성화 형태의 β-galactosidase는 X-gal에 의해서 검출 될 수 있다. 색이 없는 젖당은 β-galactosidase에 의해 잘리게 되면 5-bromo-4-chloro-indoxyl을 형성하게 되는데, 저절로 이량체가 되고 산화되어 밝은 색을 내는 녹지 않는 색소인 5,5'-dibromo-4,4'-dichloro-indigo를 형성한다. 이 결과는 왜 기능을 하는 β-galactosidase가 있는 세포가 파란색을 띠게 되는지에 대한 이유이다. 파란 콜로니들은 그러므로 방해되지 않은, 즉 삽입되지 않은 lacZα가 있다는 것을 말해주고, 반면에 흰색 콜로니들은, X-gal이 수화되지 않았음을 말하며, lacZα에 삽입된 서열이 있어서 활성화된 β-galactosidase를 만들 수 없었음을 말한다.
실제적 고려
[편집]옳은 형태의 벡터와 컴피턴트세포들은 blue white screen을 할 때 중요한 고려대상이다. 플라스미드는 반드시 lacZα를 포함하여야한다. 예를 들어 pUC19와 pBluescript 플라스미드는 lacZα를 포함한다. E. coli세포는 lacZ유전자의 일부 서열이 지워진 돌연변이 lacZ유전자(즉, lacZΔM15)를 포함하여야한다.
또한 오페론이 포도당에도 영향을 받는 것도 생각해야한다. 포도당은 cAMP(cyclic adenosine monophsphate)의 양을 줄이고, cAMP는 CRP-cAMP복합체의 형성에도 중요하다. CRP-cAMP는 젖당오페론의 전사의 초기에 필요하다. 포도당의 존재는 젖당오페론을 불활성화시키고, 젖당 유전자는 포도당의 농도가 CRP-cAMP가 충분히 낮을 때 작동한다. 그래서 배지는 포도당을 포함하면 안 된다.
X-gal은 빛에 민감하여, X-gal은 암실에서 보관되어야한다. Isopropyl β-D-1-thiogalactopyranoside(IPTG)는 젖당오페론의 유도자로 역할을 하는데, 배지에서 LacZ의 생산을 증가시키는데 사용한다.
같이 보기
[편집]각주
[편집]- ↑ Ullmann, A.; Jacob, F.; Monod, J. (1967). “Characterization by in vitro complementation of a peptide corresponding to an operator-proximal segment of the beta-galactosidase structural gene of Escherichia coli”. 《Journal of Molecular Biology》 24 (2): 339–343. doi:10.1016/0022-2836(67)90341-5. PMID 5339877.
- ↑ Langley, K. E.; Villarejo, M. R.; Fowler, A. V.; Zamenhof, P. J.; Zabin, I. (1975). “Molecular basis of beta-galactosidase alpha-complementation”. 《Proceedings of the National Academy of Sciences of the United States of America》 72 (4): 1254–1257. doi:10.1073/pnas.72.4.1254. PMC 432510. PMID 1093175.
- ↑ Messing, J.; Gronenborn, B.; Müller-Hill, B.; Hans Hopschneider, P. (1977). “Filamentous coliphage M13 as a cloning vehicle: Insertion of a HindII fragment of the lac regulatory region in M13 replicative form in vitro”. 《Proceedings of the National Academy of Sciences of the United States of America》 74 (9): 3642–3646. doi:10.1073/pnas.74.9.3642. PMC 431673. PMID 333444.
- ↑ Vieira, J.; Messing, J. (1982). “The pUC plasmids, an M13mp7-derived system for insertion mutagenesis and sequencing with synthetic universal primers”. 《Gene》 19 (3): 259–268. doi:10.1016/0378-1119(82)90015-4. PMID 6295879.
