플라빈
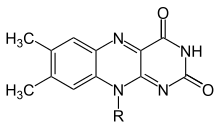

플라빈(영어: flavin)은 삼환식 헤테로고리인 아이소알록사진에 의해 형성되며, 프테리딘을 기반으로 하는 유기 화합물 그룹의 일반적인 이름이다. 플라빈이라는 이름은 노란색을 의미하는 라틴어 "flavus"에서 유래하였다. 플라빈의 생화학적 공급원은 비타민 B2인 리보플라빈이다. 플라빈 부분은 종종 아데노신 이인산(ADP)와 결합하여 플라빈 아데닌 다이뉴클레오타이드(FAD)를 형성하고, 다른 상황에서 인산화된 리보플라빈 형태인 플라빈 모노뉴클레오타이드(FMN)로 발견되기도 한다. 플라빈이 플라보단백질에서 보결분자단으로 존재하는 것은 이러한 형태들 중 하나이거나 또는 다른 형태로 존재한다.
플라빈 그룹은 산화환원반응을 수행할 수 있으며, 두 단계 과정에서 1개의 전자를 받거나 한 번에 2개의 전자를 받을 수 있다. 환원은 아이소알록사진 고리 시스템의 특정 질소 원자에 수소 원자를 첨가하는 것으로 이루어진다.
 |
수용액에서 플라빈은 산화되면 노란색을 띠고, 반환원 음이온 상태에서는 빨간색을, 중성(세미퀴논) 상태에서는 파란색을, 완전히 환원되면 무색을 띠게 된다.[1] 산화형 및 환원형은 세미퀴논(라디칼) 형태와 빠른 평형을 이루며, 라디칼 형성에 역행한다.[2]
- Flox + FlredH2 ⇌ FlH•
여기서 Flox는 산화된 플라빈이고, FlredH2는 환원된 플라빈(2개의 수소 원자 첨가시)이며, FlH•는 세미퀴논 형태(1개의 수소 원자 첨가시)이다.
FADH2의 형태는 전자를 전자전달계로 전달할 수 있는 보조 인자이다.
광환원[편집]
유리 플라빈 및 단백질 결합 플라빈은 둘 다 일부 아미노산, 카복실산, 아민과 같은 여러 유기 화합물에 의해 매개되는 메커니즘에서 광환원, 즉 빛에 의해 환원될 수 있다.[2] 플라빈의 이러한 특성은 빛에 민감한 다양한 단백질에 의해 이용된다. 예를 들어 식물, 균류, 세균의 많은 종에서 발견되는 LOV 도메인은 펩타이드 서열의 시스테인 잔기와 FMN 사이의 결합 형성을 포함하는 가역적이고 광의존적인 구조적 변화를 겪는다.[3]
FAD[편집]

플라빈 아데닌 다이뉴클레오타이드(FAD)는 페레독신-NADP+ 환원효소, 모노아민 산화효소, D-아미노산 산화효소, 포도당 산화효소, 잔틴 산화효소, 아실-CoA 탈수소효소 등 많은 효소에 결합된 그룹이다.
FADH/FADH2[편집]
FADH와 FADH2는 환원된 형태의 FAD이다. FADH2는 시트르산 회로에 관여하는 효소인 석신산 탈수소효소의 보결분자단으로 작용한다. 산화적 인산화에서 1분자의 FADH2가 산화되어 약 1.5분자의 ATP를 생성한다.
FMN[편집]
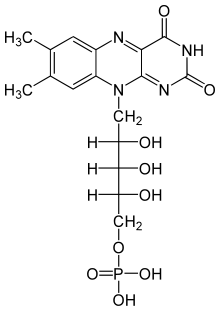
플라빈 모노뉴클레오타이드(FMN)은 NADH 탈수소효소, 대장균 나이트로리덕테이스, NADPH 탈수소효소 등에서 발견되는 보결분자단이다.
같이 보기[편집]
각주[편집]
- ↑ Michaelis L, Schubert MP, Smythe CV (1936). “Potentiometric study of the flavins.”. 《Journal of Biological Chemistry》 116 (2): 587–607. 2009년 8월 8일에 원본 문서에서 보존된 문서. 2021년 4월 14일에 확인함.
- ↑ 가 나 Massey V, Stankovich M, Hemmerich P (January 1978). “Light-mediated reduction of flavoproteins with flavins as catalysts”. 《Biochemistry》 17 (1): 1–8. doi:10.1021/bi00594a001. PMID 618535.
- ↑ Alexandre MT, Domratcheva T, Bonetti C, van Wilderen LJ, van Grondelle R, Groot ML, Hellingwerf KJ, Kennis JT (July 2009). “Primary reactions of the LOV2 domain of phototropin studied with ultrafast mid-infrared spectroscopy and quantum chemistry”. 《Biophysical Journal》 97 (1): 227–37. doi:10.1016/j.bpj.2009.01.066. PMC 2711383. PMID 19580760.
더 읽을거리[편집]
- Voet D, Voet JG (2004). 《Biochemistry》 3판. John Wiley & Sons. ISBN 0-471-39223-5.
