질산: 두 판 사이의 차이
내용 삭제됨 내용 추가됨
편집 요약 없음 |
잔글 로봇이 바꿈: vi:Axít nitric; 예쁘게 바꿈 |
||
| 4번째 줄: | 4번째 줄: | ||
순수할 때에는 무색을 띠나, 햇볕을 쪼이면 서서히 분해되어 황갈색(NO<sub>2</sub>)이 되므로 갈색 병에 넣어 보관한다. |
순수할 때에는 무색을 띠나, 햇볕을 쪼이면 서서히 분해되어 황갈색(NO<sub>2</sub>)이 되므로 갈색 병에 넣어 보관한다. |
||
<br>2HNO<sub>3</sub> + hv → 2NO<sub>2</sub>(g) + H<sub>2</sub>O + 1/2 O<sub>2</sub> |
<br />2HNO<sub>3</sub> + hv → 2NO<sub>2</sub>(g) + H<sub>2</sub>O + 1/2 O<sub>2</sub> |
||
또한 금속과 반응하면 질산염을 형성한다.<br> |
또한 금속과 반응하면 질산염을 형성한다.<br /> |
||
M(금속) + HNO<sub>3</sub> → M + NO<sub>3</sub> + H<sub>2</sub>(g) |
M(금속) + HNO<sub>3</sub> → M + NO<sub>3</sub> + H<sub>2</sub>(g) : 세척용<br /> |
||
NO<sub>3</sub><sup>-</sup> + H<sup>+</sup> + 8e<sup>-</sup> → NH<sub>4</sub><sup>+</sup> + 3H<sub>2</sub>O |
NO<sub>3</sub><sup>-</sup> + H<sup>+</sup> + 8e<sup>-</sup> → NH<sub>4</sub><sup>+</sup> + 3H<sub>2</sub>O : 감극제 |
||
{{토막글|화학}} |
{{토막글|화학}} |
||
| 63번째 줄: | 63번째 줄: | ||
[[tr:Nitrik asit]] |
[[tr:Nitrik asit]] |
||
[[uk:Нітратна кислота]] |
[[uk:Нітратна кислота]] |
||
[[vi: |
[[vi:Axít nitric]] |
||
[[zh:硝酸]] |
[[zh:硝酸]] |
||
2010년 7월 10일 (토) 22:18 판
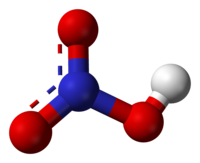
질산(窒酸, HNO3)은 무색의 부식성과 발연성이 있는 대표적인 강산이다. 초산(硝酸)이라고도 한다. 유기 화합물의 나이트로화에 쓰인다. 용액 내에 질산의 비율이 86%를 넘을 경우 발연질산(發煙窒酸)이라 부른다.
순수할 때에는 무색을 띠나, 햇볕을 쪼이면 서서히 분해되어 황갈색(NO2)이 되므로 갈색 병에 넣어 보관한다.
2HNO3 + hv → 2NO2(g) + H2O + 1/2 O2
또한 금속과 반응하면 질산염을 형성한다.
M(금속) + HNO3 → M + NO3 + H2(g) : 세척용
NO3- + H+ + 8e- → NH4+ + 3H2O : 감극제
| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
