미생물막: 두 판 사이의 차이
영어 문서 번역하여 내용 추가 |
|||
| 2번째 줄: | 2번째 줄: | ||
[[파일:Staphylococcus aureus biofilm 01.jpg|섬네일|오른쪽|200px|[[카테터]]에 서식하는 '[[황색 포도상구균]]'의 미생물막]] |
[[파일:Staphylococcus aureus biofilm 01.jpg|섬네일|오른쪽|200px|[[카테터]]에 서식하는 '[[황색 포도상구균]]'의 미생물막]] |
||
'''미생물막'''(微生物膜, {{llang|en|biofilm}})은 [[미생물]]의 집합체로, 부착표면에 [[세포]]들이 서로 들러붙은 것을 말한다. '''생물막'''(生物膜)이라고도 한다. 이러한 세포들은 종종 스스로 생산한 '세포 밖 [[중합체|고분자]] 물질'(EPS)의 망 내부에 조밀하게 끼워져 있다. 미생물막 EPS는 세포 외부의 [[유전자]], [[단백질]], [[다당류]]로 이루어진 고분자 복합체이다. |
'''미생물막'''(微生物膜, {{llang|en|biofilm}})은 [[미생물]]의 집합체로, 부착표면에 [[세포]]들이 서로 들러붙은 것을 말한다. '''생물막'''(生物膜)이라고도 한다. 이러한 세포들은 종종 스스로 생산한 '세포 밖 [[중합체|고분자]] 물질'(EPS)의 망 내부에 조밀하게 끼워져 있다. 미생물막 EPS는 세포 외부의 [[유전자]], [[단백질]], [[다당류]]로 이루어진 고분자 복합체이다. 미생물막은 생물 또는 무생물의 표면에 형성될 수 있으며, 산업 시설이나 병원등 환경공학적으로 널리 사용될 수 있다.<ref>{{저널 인용|저자=Hall-Stoodley L, Costerton JW, Stoodley P |제목=Bacterial biofilms: from the natural environment to infectious diseases |저널=[[네이처|Nature|Nature Reviews. Microbiology]] |volume=2 |issue=2 |pages=95~108 |연도=2004년 |작성월=February |pmid=15040259 |doi=10.1038/nrmicro821 }}</ref> 미생물막에서 자라는 미생물 균체는 [[생리학]]적으로 액체 배양액에 떠 있거나 헤엄치는 부유성 생물의 단일 세포 또는 [[활성슬러지]](MLSS)와는 구별된다. |
||
미생물들은 여러 요소들에 반응하여 미생물막을 형성하는데, 그 중에는 표면의 특정 또는 불특정 부착 부위의 세포의 인식. 영양 신호, 또는 경우에 따라서는 부유성 원생생물등을 포함하는 고착성 원생생물들이 환경에 노출되었을 때가 포함된다.<ref>{{저널 인용|저자=Karatan E, Watnick P |제목=Signals, regulatory networks, and materials that build and break bacterial biofilms |저널=Microbiology and Molecular Biology Reviews |volume=73 |issue=2 |pages=310~47 |연도=2009년 |작성월=6월 |pmid=19487730 |doi=10.1128/MMBR.00041-08 |url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=19487730 |pmc=2698413 }}</ref><ref>{{저널 인용|저자=Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI |제목=Aminoglycoside antibiotics induce bacterial biofilm formation |저널=Nature |volume=436 |issue=7054 |pages=1171~5 |연도=2005년 |작성월=8월 |pmid=16121184 |doi=10.1038/nature03912}}</ref> |
미생물들은 여러 요소들에 반응하여 미생물막을 형성하는데, 그 중에는 표면의 특정 또는 불특정 부착 부위의 세포의 인식. 영양 신호, 또는 경우에 따라서는 부유성 원생생물등을 포함하는 고착성 원생생물들이 환경에 노출되었을 때가 포함된다.<ref>{{저널 인용|저자=Karatan E, Watnick P |제목=Signals, regulatory networks, and materials that build and break bacterial biofilms |저널=Microbiology and Molecular Biology Reviews |volume=73 |issue=2 |pages=310~47 |연도=2009년 |작성월=6월 |pmid=19487730 |doi=10.1128/MMBR.00041-08 |url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=19487730 |pmc=2698413 }}</ref><ref>{{저널 인용|저자=Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI |제목=Aminoglycoside antibiotics induce bacterial biofilm formation |저널=Nature |volume=436 |issue=7054 |pages=1171~5 |연도=2005년 |작성월=8월 |pmid=16121184 |doi=10.1038/nature03912}}</ref>미생물막 박테리아는 영양분을 공유할 수 있으며 건조, 항생제 및 숙주 신체의 면역 체계와 같은 환경의 유해 요인으로부터 보호기능을 한다. 미생물막은 일반적으로 자유롭게 헤엄치는 박테리아가 표면에 부착될 때 형성되기 시작한다.<ref>Case C, Funke B, Tortora G. Microbiology An Introduction (tenth ed.)</ref> |
||
== 기원과 형성 == |
|||
==생물막법== |
|||
| ⚫ | |||
| ⚫ | |||
== |
=== 기원 === |
||
미생물막은 원시 지구에서 원핵생물의 방어 메커니즘으로 발생했을 것으로 추정된다. 당시의 조건은 생존하기에 너무 가혹했기 때문이다. 그들은 지구 화석 기록(약 32억 5000만 년 전)에서 존재한 고세균과 박테리아로 매우 초기에 발견될 수 있으며 일반적으로 원핵 세포에 항상성을 제공하여 미생물막에서 세포 사이의 복잡한 상호 작용의 발달을 촉진하여 원핵 세포를 보호한다.<ref>{{저널 인용|제목=Bacterial biofilms: from the Natural environment to infectious diseases|저널=Nature Reviews Microbiology|성=Hall-Stoodley|이름=Luanne|성2=Costerton|이름2=J. William|url=http://www.nature.com/articles/nrmicro821|날짜=2004-02|권=2|호=2|쪽=95–108|언어=en|doi=10.1038/nrmicro821|issn=1740-1526|성3=Stoodley|이름3=Paul}}</ref> |
|||
=== 형성 === |
|||
미생물막의 형성은 표면에 자유롭게 떠 있는 미생물의 부착으로 시작된다.<ref>{{저널 인용|제목=Biofilm, City of Microbes|저널=Journal of Bacteriology|성=Watnick|이름=Paula|성2=Kolter|이름2=Roberto|url=https://journals.asm.org/doi/10.1128/JB.182.10.2675-2679.2000|날짜=2000-05-15|권=182|호=10|쪽=2675–2679|언어=en|doi=10.1128/JB.182.10.2675-2679.2000|issn=0021-9193|pmc=PMC101960|pmid=10781532}}</ref><ref>{{저널 인용|제목=Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis|저널=Molecular Microbiology|성=O'Toole|이름=George A.|성2=Kolter|이름2=Roberto|url=https://onlinelibrary.wiley.com/doi/abs/10.1046/j.1365-2958.1998.00797.x|날짜=1998-04|권=28|호=3|쪽=449–461|언어=en|doi=10.1046/j.1365-2958.1998.00797.x|issn=0950-382X}}</ref> 미생물막의 첫 번째 콜로니 박테리아는 약한 반데르발스 힘과 소수성 효과에 의해 초기에 표면에 부착될 수 있다.<ref>{{저널 인용|제목=Determination of the van der Waals, electron donor and electron acceptor surface tension components of static Gram-positive microbial biofilms|저널=Colloids and Surfaces B: Biointerfaces|성=Briandet|이름=R|성2=Herry|이름2=J.-M|url=https://linkinghub.elsevier.com/retrieve/pii/S0927776500002137|날짜=2001-08|권=21|호=4|쪽=299–310|언어=en|doi=10.1016/S0927-7765(00)00213-7|성3=Bellon-Fontaine|이름3=M.-N}}</ref><ref>{{저널 인용|제목=Cellular hydrophobicity of Listeria monocytogenes involves initial attachment and biofilm formation on the surface of polyvinyl chloride: Cellular properties and biofilm formation of L. monocytogenes|저널=Letters in Applied Microbiology|성=Takahashi|이름=H.|성2=Suda|이름2=T.|url=https://onlinelibrary.wiley.com/doi/10.1111/j.1472-765X.2010.02842.x|날짜=2010-03-22|권=50|호=6|쪽=618–625|언어=en|doi=10.1111/j.1472-765X.2010.02842.x|성3=Tanaka|이름3=Y.|성4=Kimura|이름4=B.}}</ref> 콜로니의 균이 표면에서 즉시 분리되지 않으면 필리와 같은 세포 접착 구조를 사용하여 더 영구적으로 정착할 수 있다. 무산소 지하수에 서식하는 독특한 고세균군은 하미(hami)라고 불리는 유사한 구조를 가지고 있다. 각 하무스(hamus)는 서로 또는 표면에 부착하는 데 사용되는 3개의 갈고리 부착물이 있는 긴 튜브로 커뮤니티가 발전할 수 있도록 한다.<ref>{{서적 인용|url=https://www.worldcat.org/oclc/1007929699|제목=Brock biology of microorganisms|성=Madigan|이름=Michael T.|날짜=2019|판=Fifteenth edition, Global edition|위치=NY, NY|쪽=86|isbn=978-1-292-23510-3}}</ref> 고온성 고세균인 Pyrobaculum calidifontis는 박테리아 미생물막 안정성에 기여하는 박테리아 미생물막의 세포외 기질의 주요 구성요소인 박테리아 TasA 필라멘트와 상동인 번들링 필리를 생성한다.<ref name=":0">{{저널 인용|제목=Archaeal bundling pili of Pyrobaculum calidifontis reveal similarities between archaeal and bacterial biofilms|저널=Proceedings of the National Academy of Sciences|성=Wang|이름=Fengbin|성2=Cvirkaite-Krupovic|이름2=Virginija|url=https://pnas.org/doi/full/10.1073/pnas.2207037119|날짜=2022-06-28|권=119|호=26|쪽=e2207037119|언어=en|doi=10.1073/pnas.2207037119|issn=0027-8424|pmc=PMC9245690|pmid=35727984|성3=Krupovic|이름3=Mart|성4=Egelman|이름4=Edward H.}}</ref> TasA 상동체는 다른 많은 고세균에 의해 암호화되어 있으며, 이는 세균과 고세균 미생물막 사이의 기계적 유사성과 진화적 연결을 시사한다.<ref name=":0" /> |
|||
소수성은 또한 박테리아가 미생물막을 형성하는 능력에 영향을 줄 수 있다. 증가된 소수성을 가진 박테리아는 기질과 박테리아 사이의 반발력을 감소시켰다.<ref name=":1">{{저널 인용|제목=Biofilms: Microbial Life on Surfaces|저널=Emerging Infectious Diseases|성=Donlan|이름=Rodney M.|url=http://wwwnc.cdc.gov/eid/article/8/9/02-0063_article.htm|날짜=2002-09|권=8|호=9|쪽=881–890|doi=10.3201/eid0809.020063|issn=1080-6040|pmc=PMC2732559|pmid=12194761}}</ref> 일부 박테리아 종은 제한된 운동성으로 인해 자체적으로 표면에 성공적으로 부착할 수 없지만 대신 매트릭스에 스스로를 고정하거나 다른 초기 박테리아 콜로니에 직접 고정할 수 있다. 비운동성 박테리아는 운동성 박테리아만큼 쉽게 표면을 인식하거나 함께 뭉칠 수 없다.<ref name=":1" /> |
|||
표면 집락화 동안 박테리아 세포는 N-아실 호모세린 락톤(AHL)과 같은 정족수 감지(QS) 제품을 사용하여 통신할 수 있다. 일단 콜로니화가 시작되면 미생물막은 세포 분열과 모집의 조합에 의해 성장한다. 다당류 매트릭스는 일반적으로 박테리아 미생물막을 둘러싸고 있다. 기질 엑소폴리사카라이드는 포식자 탐지를 방지하고 박테리아 생존을 보장하기 위해 미생물막 내에 QS 자가유도제를 가둘 수 있다.<ref>{{저널 인용|제목=Biofilm matrix cloaks bacterial quorum sensing chemoattractants from predator detection|저널=The ISME Journal|성=Li|이름=Shaoyang|성2=Liu|이름2=Sylvia Yang|url=https://www.nature.com/articles/s41396-022-01190-2|날짜=2022-05|권=16|호=5|쪽=1388–1396|언어=en|doi=10.1038/s41396-022-01190-2|issn=1751-7362|pmc=PMC9038794|pmid=35034106|성3=Chan|이름3=Shepherd Yuen|성4=Chua|이름4=Song Lin}}</ref> 다당류 외에도 이러한 매트릭스에는 미네랄, 토양 입자 및 적혈구 및 섬유소와 같은 혈액 성분을 포함하지만 이에 국한되지 않는 주변 환경의 물질이 포함될 수 있다.<ref name=":1" /> 미생물막 형성의 마지막 단계는 분산으로 알려져 있으며 미생물막이 형성되고 모양과 크기만 변할 수 있는 단계이다. |
|||
미생물막의 발달은 응집 세포 군체(또는 군체)가 점점 더 내성이 생기거나<ref>{{저널 인용|제목=Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial Agents—How P. aeruginosa Can Escape Antibiotics|저널=Frontiers in Microbiology|성=Ciofu|이름=Oana|성2=Tolker-Nielsen|이름2=Tim|url=https://www.frontiersin.org/article/10.3389/fmicb.2019.00913/full|날짜=2019-05-03|권=10|쪽=913|doi=10.3389/fmicb.2019.00913|issn=1664-302X|pmc=PMC6509751|pmid=31130925}}</ref> 항생제에 내성을 갖도록 할 수 있다. 세포 간 통신 또는 정족수 감지는 여러 박테리아 종에서 미생물막 형성에 관여하는 것으로 나타났다.<ref>{{저널 인용|제목=Quorum-Sensing Regulation of the Biofilm Matrix Genes ( pel ) of Pseudomonas aeruginosa|저널=Journal of Bacteriology|성=Sakuragi|이름=Yumiko|성2=Kolter|이름2=Roberto|url=https://journals.asm.org/doi/10.1128/JB.00137-07|날짜=2007-07-15|권=189|호=14|쪽=5383–5386|언어=en|doi=10.1128/JB.00137-07|issn=0021-9193|pmc=PMC1951888|pmid=17496081}}</ref> |
|||
== 개발 == |
|||
미생물막은 미생물 발달 과정의 산물이다.<ref>{{저널 인용|제목=Biofilm Formation as Microbial Development|저널=Annual Review of Microbiology|성=O'Toole|이름=George|성2=Kaplan|이름2=Heidi B.|url=https://www.annualreviews.org/doi/10.1146/annurev.micro.54.1.49|날짜=2000-10|권=54|호=1|쪽=49–79|언어=en|doi=10.1146/annurev.micro.54.1.49|issn=0066-4227|성3=Kolter|이름3=Roberto}}</ref> 이 과정은 아래 다이어그램과 같이 미생물막 개발의 5가지 주요 단계로 요약된다.<ref>{{저널 인용|제목=Looking for Chinks in the Armor of Bacterial Biofilms|저널=PLoS Biology|성=Monroe|이름=Don|url=https://dx.plos.org/10.1371/journal.pbio.0050307|날짜=2007-11-13|권=5|호=11|쪽=e307|언어=en|doi=10.1371/journal.pbio.0050307|issn=1545-7885|pmc=PMC2071939|pmid=18001153}}</ref> |
|||
[[파일:Mature_biofilm_structure.png|오른쪽|섬네일|{{center|'''Mature biofilm structure'''{{hsp}}<ref name="Rapacka-Zdonczyk2021">{{cite journal | vauthors = Rapacka-Zdonczyk A, Wozniak A, Nakonieczna J, Grinholc M | title = Development of Antimicrobial Phototreatment Tolerance: Why the Methodology Matters | journal = International Journal of Molecular Sciences | volume = 22 | issue = 4 | page = 2224 | date = February 2021 | pmid = 33672375 | pmc = 7926562 | doi = 10.3390/ijms22042224 | publisher = MDPI AG | doi-access = free }} [[File:CC-BY icon.svg|50px]] Material was copied from this source, which is available under a [https://creativecommons.org/licenses/by/4.0/ Creative Commons Attribution 4.0 International License].</ref>}}Biofilm is characterised by heterogenous environment and the presence of a variety of subpopulations. A biofilm structure is composed of metabolically active (both resistant and tolerant) and non-active cells (viable but not culturable cells and persisters) as well as polymer matrix consisting of polysaccharide, extracellular DNA and proteins. Biofilm growth is associated with an escalated level of mutations and [[horizontal gene transfer]] which is promoted in due to the packed and dense structure. Bacteria in biofilms communicate by [[quorum sensing]], which activates genes participating in virulence factors production.<ref name="Rapacka-Zdonczyk2021" /><ref>{{cite journal|title=Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria|journal=FEMS Microbiology Reviews|date=May 2017|volume=41|issue=3|publisher=Oxford University Press (OUP)|pages=276–301|doi=10.1093/femsre/fux010|pmid=28369412|vauthors=Hall CW, Mah TF}}</ref>]] |
|||
[[파일:Biofilm.jpg|왼쪽|섬네일|{{center|'''Five stages of biofilm development'''{{hsp}}<ref name="Monroe2007" />}}(1) Initial attachment, (2) Irreversible attachment, (3) Maturation I, (4) Maturation II, and (5) Dispersion. Each stage of development in the diagram is paired with a [[photomicrograph]] of a developing ''P. aeruginosa'' biofilm. All photomicrographs are shown to the same scale.]] |
|||
== 분산 == |
|||
미생물막 콜로니에서 세포의 분산은 미생물막 수명 주기의 필수 단계이다. 분산은 미생물막이 새로운 표면을 퍼뜨리고 콜로니화할 수 있도록 한다. dispersin B 및 deoxyribonuclease와 같은 미생물막 세포외 기질을 분해하는 효소는 미생물막 분산에 기여할 수 있다.<ref>{{저널 인용|제목=Detachment of Actinobacillus actinomycetemcomitans Biofilm Cells by an Endogenous β-Hexosaminidase Activity|저널=Journal of Bacteriology|성=Kaplan|이름=Jeffrey B.|성2=Ragunath|이름2=Chandran|url=https://journals.asm.org/doi/10.1128/JB.185.16.4693-4698.2003|날짜=2003-08-15|권=185|호=16|쪽=4693–4698|언어=en|doi=10.1128/JB.185.16.4693-4698.2003|issn=0021-9193|pmc=PMC166467|pmid=12896987|성3=Ramasubbu|이름3=Narayanan|성4=Fine|이름4=Daniel H.}}</ref><ref>{{저널 인용|제목=Differential Roles of Poly- N -Acetylglucosamine Surface Polysaccharide and Extracellular DNA in Staphylococcus aureus and Staphylococcus epidermidis Biofilms|저널=Applied and Environmental Microbiology|성=Izano|이름=Era A.|성2=Amarante|이름2=Matthew A.|url=https://journals.asm.org/doi/10.1128/AEM.02073-07|날짜=2008-01-15|권=74|호=2|쪽=470–476|언어=en|doi=10.1128/AEM.02073-07|issn=0099-2240|pmc=PMC2223269|pmid=18039822|성3=Kher|이름3=William B.|성4=Kaplan|이름4=Jeffrey B.}}</ref> 미생물막 기질을 분해하는 효소는 항미생물막 제제로 유용할 수 있다.<ref>{{저널 인용|제목=Enzymatic Detachment of Staphylococcus epidermidis Biofilms|저널=Antimicrobial Agents and Chemotherapy|성=Kaplan|이름=Jeffrey B.|성2=Ragunath|이름2=Chandran|url=https://journals.asm.org/doi/10.1128/AAC.48.7.2633-2636.2004|날짜=2004-07|권=48|호=7|쪽=2633–2636|언어=en|doi=10.1128/AAC.48.7.2633-2636.2004|issn=0066-4804|성3=Velliyagounder|이름3=Kabilan|성4=Fine|이름4=Daniel H.|성5=Ramasubbu|이름5=Narayanan}}</ref><ref>{{저널 인용|제목=Biofilm-control strategies based on enzymic disruption of the extracellular polymeric substance matrix – a modelling study|저널=Microbiology|성=Xavier|이름=Joao B.|성2=Picioreanu|이름2=Cristian|url=https://www.microbiologyresearch.org/content/journal/micro/10.1099/mic.0.28165-0|날짜=2005-12-01|권=151|호=12|쪽=3817–3832|언어=en|doi=10.1099/mic.0.28165-0|issn=1350-0872|성3=Rani|이름3=Suriani Abdul|성4=van Loosdrecht|이름4=Mark C. M.|성5=Stewart|이름5=Philip S.}}</ref> 증거에 따르면 지방산 메신저인 cis-2-decenoic acid는 분산을 유도하고 미생물막 집락의 성장을 억제할 수 있다. 녹농균(Pseudomonas aeruginosa)에 의해 분비되는 이 화합물은 여러 종의 박테리아와 효모 칸디다 알비칸스(Candida albicans)에서 사이클로 이형 세포를 유도한다.<ref>{{저널 인용|제목=A Fatty Acid Messenger Is Responsible for Inducing Dispersion in Microbial Biofilms|저널=Journal of Bacteriology|성=Davies|이름=David G.|성2=Marques|이름2=Cláudia N. H.|url=https://journals.asm.org/doi/10.1128/JB.01214-08|날짜=2009-03|권=191|호=5|쪽=1393–1403|언어=en|doi=10.1128/JB.01214-08|issn=0021-9193|pmc=PMC2648214|pmid=19074399}}</ref> 산화질소는 또한 독성이 없는 농도에서 여러 박테리아 종<ref>{{저널 인용|제목=Involvement of Nitric Oxide in Biofilm Dispersal of Pseudomonas aeruginosa|저널=Journal of Bacteriology|성=Barraud|이름=Nicolas |성2=Hassett|이름2=Daniel J.|url=https://journals.asm.org/doi/10.1128/JB.00779-06|날짜=2006-11|권=188|호=21|쪽=7344–7353|언어=en|doi=10.1128/JB.00779-06|issn=0021-9193|pmc=PMC1636254|pmid=17050922|성3=Hwang|이름3=Sung-Hei|성4=Rice|이름4=Scott A.|성5=Kjelleberg|이름5=Staffan|성6=Webb|이름6=Jeremy S.}}</ref><ref>{{저널 인용|제목=Nitric oxide-mediated dispersal in single- and multi-species biofilms of clinically and industrially relevant microorganisms: NO-mediated dispersal in bacterial biofilms|저널=Microbial Biotechnology|성=Barraud|이름=Nicolas|성2=Storey|이름2=Michael V.|url=https://onlinelibrary.wiley.com/doi/10.1111/j.1751-7915.2009.00098.x|날짜=2009-05|권=2|호=3|쪽=370–378|언어=en|doi=10.1111/j.1751-7915.2009.00098.x|pmc=PMC3815757|pmid=21261931|성3=Moore|이름3=Zoe P.|성4=Webb|이름4=Jeremy S.|성5=Rice|이름5=Scott A.|성6=Kjelleberg|이름6=Staffan}}</ref>의 미생물막 분산을 유발하는 것으로 나타났다. 산화질소는 미생물막으로 인한 만성 감염이 있는 환자의 치료제로 잠재력이 있다.<ref>{{웹 인용|url=https://www.southampton.ac.uk/biosci/research/projects/dispersal_of_biofilms_in_cystic_fibrosis.page|제목=Dispersal of Biofilms in Cystic Fibrosis {{!}} Biological Sciences {{!}} University of Southampton|확인날짜=2022-10-13}}</ref> |
|||
일반적으로 미생물막에서 분산된 세포는 즉시 플랑크톤 성장 단계에 들어간다고 가정했다. 그러나 연구에 따르면 녹농균(Pseudomonas aeruginosa) 미생물막에서 분산된 세포의 생리학은 플랑크톤 및 미생물막 세포의 생리학과 크게 다르다.<ref name=":2">{{저널 인용|제목=Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles|저널=Nature Communications|성=Chua|이름=Song Lin|성2=Liu|이름2=Yang|url=http://www.nature.com/articles/ncomms5462|날짜=2014-12-17|권=5|호=1|쪽=4462|언어=en|doi=10.1038/ncomms5462|issn=2041-1723|성3=Yam|이름3=Joey Kuok Hoong|성4=Chen|이름4=Yicai|성5=Vejborg|이름5=Rebecca Munk|성6=Tan|이름6=Bryan Giin Chyuan|성7=Kjelleberg|이름7=Staffan|성8=Tolker-Nielsen|이름8=Tim|성9=Givskov|이름9=Michael}}</ref><ref>{{저널 인용|제목=In vitro and in vivo generation and characterization of Pseudomonas aeruginosa biofilm–dispersed cells via c-di-GMP manipulation|저널=Nature Protocols|성=Chua|이름=Song Lin|성2=Hultqvist|이름2=Louise D|url=http://www.nature.com/articles/nprot.2015.067|날짜=2015-08|권=10|호=8|쪽=1165–1180|언어=en|doi=10.1038/nprot.2015.067|issn=1754-2189|성3=Yuan|이름3=Mingjun|성4=Rybtke|이름4=Morten|성5=Nielsen|이름5=Thomas E|성6=Givskov|이름6=Michael|성7=Tolker-Nielsen|이름7=Tim|성8=Yang|이름8=Liang}}</ref> 따라서 분산 과정은 미생물막에서 박테리아의 플랑크톤 생활 방식으로 전환하는 동안 독특한 단계이다. 분산된 세포는 대식세포와 Caenorhabditis elegans에 대해 독성이 높지만 플랑크톤 세포에 비해 철 스트레스에 매우 민감한 것으로 밝혀졌다.<ref name=":2" /> |
|||
== 속성 == |
|||
미생물막은 일반적으로 수용액에 잠겨 있거나 수용액에 노출된 고체 기질에서 발견되지만 특히 습도가 높은 기후에서는 액체 표면과 잎 표면에 떠 있는 매트로 형성될 수 있다. 성장을 위한 충분한 자원이 주어지면 미생물막은 육안으로 볼 수 있는 거시적으로 빠르게 성장할 것이다. 미생물막에는 다양한 유형의 미생물이 포함될 수 있다. 박테리아, 고세균, 원생동물, 균류 및 조류 등의 각 그룹은 특수 대사 기능을 수행한다. 그러나 일부 유기체는 특정 조건에서 단일 종만으로 필름을 형성한다. 미생물막 내의 사회 구조(협력/경쟁)는 기존에 존재한 다른 종에 크게 의존한다.<ref>{{저널 인용|제목=The sociobiology of biofilms|저널=FEMS Microbiology Reviews|성=Nadell|이름=Carey D.|성2=Xavier|이름2=Joao B.|url=https://academic.oup.com/femsre/article-lookup/doi/10.1111/j.1574-6976.2008.00150.x|날짜=2009-01|권=33|호=1|쪽=206–224|언어=en|doi=10.1111/j.1574-6976.2008.00150.x|issn=1574-6976|성3=Foster|이름3=Kevin R.}}</ref> |
|||
=== 세포외 기질 === |
|||
세포외기질은 엑소폴리사카라이드, 단백질 및 핵산으로 구성된다.<ref>{{저널 인용|제목=Pseudomonas aeruginosa Biofilm Infections: Community Structure, Antimicrobial Tolerance and Immune Response|저널=Journal of Molecular Biology|성=Rybtke|이름=Morten|성2=Hultqvist|이름2=Louise Dahl|url=https://linkinghub.elsevier.com/retrieve/pii/S0022283615004817|날짜=2015-11|권=427|호=23|쪽=3628–3645|언어=en|doi=10.1016/j.jmb.2015.08.016|성3=Givskov|이름3=Michael|성4=Tolker-Nielsen|이름4=Tim}}</ref><ref>{{저널 인용|제목=Exopolysaccharide Production Is Required for Development of Escherichia coli K-12 Biofilm Architecture|저널=Journal of Bacteriology|성=Danese|이름=Paul N.|성2=Pratt|이름2=Leslie A.|url=https://journals.asm.org/doi/10.1128/JB.182.12.3593-3596.2000|날짜=2000-06-15|권=182|호=12|쪽=3593–3596|언어=en|doi=10.1128/JB.182.12.3593-3596.2000|issn=0021-9193|pmc=PMC101973|pmid=10852895|성3=Kolter|이름3=Roberto}}</ref><ref>{{저널 인용|제목=A major protein component of the Bacillus subtilis biofilm matrix|저널=Molecular Microbiology|성=Branda|이름=Steven S.|성2=Chu|이름2=Frances|url=https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2958.2005.05020.x|날짜=2006-02|권=59|호=4|쪽=1229–1238|언어=en|doi=10.1111/j.1365-2958.2005.05020.x|issn=0950-382X|성3=Kearns|이름3=Daniel B.|성4=Losick|이름4=Richard|성5=Kolter|이름5=Roberto}}</ref> EPS의 많은 부분이 다소 강하게 수화되지만 소수성 EPS도 발생한다. 한 가지 예는 다양한 미생물에 의해 생산되는 셀룰로오스<ref>{{저널 인용|제목=Real-time optotracing of curli and cellulose in live Salmonella biofilms using luminescent oligothiophenes|저널=npj Biofilms and Microbiomes|성=Choong|이름=Ferdinand X|성2=Bäck|이름2=Marcus|url=http://www.nature.com/articles/npjbiofilms201624|날짜=2016-11|권=2|호=1|쪽=16024|언어=en|doi=10.1038/npjbiofilms.2016.24|issn=2055-5008|pmc=PMC5515270|pmid=28721253|성3=Fahlén|이름3=Sara|성4=Johansson|이름4=Leif BG|성5=Melican|이름5=Keira|성6=Rhen|이름6=Mikael|성7=Nilsson|이름7=K Peter R|성8=Richter-Dahlfors|이름8=Agneta}}</ref>이다. 이 매트릭스는 그 안에 있는 세포를 감싸고 생화학적 신호와 유전자 교환을 통해 세포 간의 의사 소통을 촉진한다. EPS 매트릭스는 또한 세포외 효소를 포획하여 세포에 가깝게 유지한다. 따라서 매트릭스는 외부 소화 시스템을 나타내며 다른 종의 안정적인 시너지 마이크로컨소시엄을 허용한다.<ref>{{저널 인용|제목=Biofilms: an emergent form of bacterial life|저널=Nature Reviews Microbiology|성=Flemming|이름=Hans-Curt|성2=Wingender|이름2=Jost|url=http://www.nature.com/articles/nrmicro.2016.94|날짜=2016-09|권=14|호=9|쪽=563–575|언어=en|doi=10.1038/nrmicro.2016.94|issn=1740-1526|성3=Szewzyk|이름3=Ulrich|성4=Steinberg|이름4=Peter|성5=Rice|이름5=Scott A.|성6=Kjelleberg|이름6=Staffan}}</ref> 일부 미생물막은 영양분과 신호 분자를 분배하는 데 도움이 되는 수로를 포함하는 것으로 밝혀졌다.<ref>{{저널 인용|제목=Liquid Flow in Biofilm Systems|저널=Applied and Environmental Microbiology|성=Stoodley|이름=Paul|성2=deBeer|이름2=Dirk|url=https://journals.asm.org/doi/10.1128/aem.60.8.2711-2716.1994|날짜=1994-08|권=60|호=8|쪽=2711–2716|언어=en|doi=10.1128/aem.60.8.2711-2716.1994|issn=0099-2240|pmc=PMC201713|pmid=16349345|성3=Lewandowski|이름3=Zbigniew}}</ref> 이 매트릭스는 특정 조건에서 미생물막이 화석화될 수 있을 만큼 충분히 강하다(스트로마톨라이트). |
|||
미생물막에 서식하는 박테리아는 일반적으로 동일한 종의 자유 부유 박테리아와 상당히 다른 특성을 가지고 있다. 막의 조밀하고 보호된 환경에서 다양한 방식으로 협력하고 상호 작용할 수 있기 때문이다.<ref>{{저널 인용|제목=Control of cell fate by the formation of an architecturally complex bacterial community|저널=Genes & Development|성=Vlamakis|이름=Hera|성2=Aguilar|이름2=Claudio|url=http://genesdev.cshlp.org/lookup/doi/10.1101/gad.1645008|날짜=2008-04-01|권=22|호=7|쪽=945–953|언어=en|doi=10.1101/gad.1645008|issn=0890-9369|pmc=PMC2279205|pmid=18381896|성3=Losick|이름3=Richard|성4=Kolter|이름4=Roberto}}</ref> 이 환경의 한 가지 이점은 조밀한 세포외 기질과 세포의 외부층이 공동체 내부를 보호하기 때문에 세제와 항생제에 대한 내성이 증가한다는 것이다.<ref>{{저널 인용|제목=Antibiotic resistance of bacteria in biofilms|저널=The Lancet|성=Stewart|이름=Philip S|성2=William Costerton|이름2=J|url=https://linkinghub.elsevier.com/retrieve/pii/S0140673601053211|날짜=2001-07|권=358|호=9276|쪽=135–138|언어=en|doi=10.1016/S0140-6736(01)05321-1}}</ref><ref>{{저널 인용|제목=Characterisation of ESKAPE Pathogens with Special Reference to Multidrug Resistance and Biofilm Production in a Nepalese Hospital|저널=Infection and Drug Resistance|성=Pandey|이름=Rosy|성2=Mishra|이름2=Shyam Kumar|url=https://www.dovepress.com/characterisation-of-eskape-pathogens-with-special-reference-to-multidr-peer-reviewed-fulltext-article-IDR|날짜=2021-06|권=Volume 14|쪽=2201–2212|언어=en|doi=10.2147/IDR.S306688|issn=1178-6973|성3=Shrestha|이름3=Angela}}</ref> 어떤 경우에는 항생제 내성이 5,000배까지 증가할 수 있다.<ref>{{저널 인용|제목=Bioelectric Effect and Bacterial Biofilms. a Systematic Review|저널=The International Journal of Artificial Organs|성=Del Pozo|이름=J. L.|성2=Rouse|이름2=M. S.|url=http://journals.sagepub.com/doi/10.1177/039139880803100906|날짜=2008-09|권=31|호=9|쪽=786–795|언어=en|doi=10.1177/039139880803100906|issn=0391-3988|pmc=PMC3910516|pmid=18924090|성3=Patel|이름3=R.}}</ref> 측면 유전자 전달은 종종 세균 및 고세균 미생물막 내에서 촉진되고<ref>{{저널 인용|제목=Biofilms formed by the archaeon Haloferax volcaniiexhibit cellular differentiation and social motility, and facilitate horizontal gene transfer|저널=BMC Biology|성=Chimileski|이름=Scott|성2=Franklin|이름2=Michael J|url=https://bmcbiol.biomedcentral.com/articles/10.1186/s12915-014-0065-5|날짜=2014-12|권=12|호=1|쪽=65|언어=en|doi=10.1186/s12915-014-0065-5|issn=1741-7007|성3=Papke|이름3=R Thane}}</ref> 보다 안정적인 미생물막 구조로 이어진다.<ref>{{저널 인용|제목=Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure|저널=Current Opinion in Biotechnology|성=Molin|이름=Søren|성2=Tolker-Nielsen|이름2=Tim|url=https://linkinghub.elsevier.com/retrieve/pii/S0958166903000363|날짜=2003-06|권=14|호=3|쪽=255–261|언어=en|doi=10.1016/S0958-1669(03)00036-3}}</ref> 세포외 DNA는 다양한 미생물 미생물막의 주요 구조적 구성요소이다.<ref>{{저널 인용|제목=Life after death: the critical role of extracellular DNA in microbial biofilms|저널=Letters in Applied Microbiology|성=Jakubovics|이름=N.S.|성2=Shields|이름2=R.C.|url=https://onlinelibrary.wiley.com/doi/10.1111/lam.12134|날짜=2013-12|권=57|호=6|쪽=467–475|언어=en|doi=10.1111/lam.12134|성3=Rajarajan|이름3=N.|성4=Burgess|이름4=J.G.}}</ref> 세포외 DNA의 효소적 분해는 미생물막 구조를 약화시키고 표면에서 미생물 세포를 방출할 수 있다. |
|||
그러나 미생물막이 항상 항생제에 덜 민감한 것은 아니다. 예를 들어, 녹농균(Pseudomonas aeruginosa)의 미생물막 형태는 고정상 플랑크톤 세포보다 항균제에 대한 내성이 크지 않지만, 미생물막이 대수상 플랑크톤 세포와 비교할 때 미생물막은 항균제에 대한 내성이 더 크다. 정지상 세포와 미생물막 모두에서 항생제에 대한 이러한 내성은 지속 세포의 존재 때문일 수 있다.<ref>{{저널 인용|제목=Biofilms and Planktonic Cells of Pseudomonas aeruginosa Have Similar Resistance to Killing by Antimicrobials|저널=Journal of Bacteriology|성=Spoering|이름=Amy L.|성2=Lewis|이름2=Kim|url=https://journals.asm.org/doi/10.1128/JB.183.23.6746-6751.2001|날짜=2001-12|권=183|호=23|쪽=6746–6751|언어=en|doi=10.1128/JB.183.23.6746-6751.2001|issn=0021-9193|pmc=PMC95513|pmid=11698361}}</ref> |
|||
==활용== |
|||
{{출처 필요 문단}} |
|||
| ⚫ | |||
| ⚫ | |||
==원생생물== |
|||
[[보티셀라]](vorticella)같은 [[원생생물]] 등이 주요하게 이를 형성한다. |
[[보티셀라]](vorticella)같은 [[원생생물]] 등이 주요하게 이를 형성한다. |
||
== 수평적 유전자 전달 == |
|||
수평적 유전자 전달은 세포 유기체 사이의 유전 물질 전달 방법이다. 원핵 생물에서 자주 발생하고 진핵 생물에서는 덜 발생한다. 박테리아에서 수평적 유전자 전달은 형질전환(환경에서 자유 부유 DNA의 흡수), 형질도입(바이러스 매개 DNA 흡수) 또는 접합(두 인접 박테리아의 선모 구조 사이의 DNA 전달)을 통해 발생할 수 있다.[156] 최근 연구에서는 막 소포 전달 또는 유전자 전달제와 같은 다른 메커니즘도 밝혀냈다.<ref name=":3">{{저널 인용|제목=Formation, Development, and Cross-Species Interactions in Biofilms|저널=Frontiers in Microbiology|성=Luo|이름=Aihua|성2=Wang|이름2=Fang|url=https://www.frontiersin.org/articles/10.3389/fmicb.2021.757327/full|날짜=2022-01-04|권=12|쪽=757327|doi=10.3389/fmicb.2021.757327|issn=1664-302X|pmc=PMC8764401|pmid=35058893|성3=Sun|이름3=Degang|성4=Liu|이름4=Xueyu|성5=Xin|이름5=Bingchang}}</ref> 미생물막은 다양한 방식으로 수평적 유전자 전달을 촉진한다. |
|||
미생물막은 접합을 촉진하여 많은 미생물막의 다양한 이질성으로 인해 종종 종간 이동을 촉진한다. 또한, 미생물막은 다당류 매트릭스에 의해 구조적으로 제한되어 접합을 위한 긴밀한 공간 요구 사항을 제공한다. 형질전환은 미생물막에서도 자주 관찰된다. 박테리아 자가분해는 미생물막 구조 조절의 핵심 메커니즘으로, 변형 흡수를 위해 준비된 유능한 DNA의 풍부한 소스를 제공한다.<ref name=":3" /><ref>{{저널 인용|제목=Suicide and Fratricide in Bacterial Biofilms|저널=The International Journal of Artificial Organs|성=Thomas|이름=Vinai Chittezham|성2=Hancock|이름2=Lynn E.|url=http://journals.sagepub.com/doi/10.1177/039139880903200902|날짜=2009-09|권=32|호=9|쪽=537–544|언어=en|doi=10.1177/039139880903200902|issn=0391-3988}}</ref> 어떤 경우에는 미생물막 간 정족수 감지가 자유 부동 eDNA의 능력을 향상시켜 형질전환을 더욱 촉진할 수 있다.<ref name=":3" /> 박테리오파지 운반체를 통한 Stx 유전자 전달은 미생물막 내에서 목격되었으며, 이는 미생물막이 형질도입에 적합한 환경임을 시사한다.<ref name=":3" /> 막 소포 HGT는 방출된 막 소포(유전 정보 포함)가 수용 박테리아와 융합하고 유전 물질을 박테리아의 세포질로 방출할 때 발생한다.<ref name=":3" /> 최근 연구에 따르면 막 소포 HGT가 단일 균주 미생물막 형성을 촉진할 수 있지만 막 소포 HGT가 다중 균주 미생물막 형성에서 수행하는 역할은 아직 알려져 있지 않다. GTA 또는 유전자 전달제는 숙주 박테리아에 의해 생성되는 파지 같은 입자이며 숙주 박테리아 게놈에서 무작위 DNA 단편을 포함한다.<ref name=":3" /> 미생물막 내의 HGT는 미생물막 개체군 전체에 항생제 내성 또는 증가된 병원성을 부여하여 미생물막 항상성을 촉진할 수 있다.<ref name=":3" /> |
|||
=== 예시 === |
|||
접합 플라스미드는 세포 접착을 촉진하는 PtgA, PrgB 또는 PrgC와 같은 미생물막 관련 단백질을 암호화 할 수 있다(조기 미생물막 형성에 필요).<ref name=":4">{{저널 인용|제목=Biofilms: hot spots of horizontal gene transfer (HGT) in aquatic environments, with a focus on a new HGT mechanism|저널=FEMS Microbiology Ecology|성=Abe|이름=Kimihiro|성2=Nomura|이름2=Nobuhiko|url=https://academic.oup.com/femsec/article/doi/10.1093/femsec/fiaa031/5766226|날짜=2020-05-01|권=96|호=5|쪽=fiaa031|언어=en|doi=10.1093/femsec/fiaa031|issn=0168-6496|pmc=PMC7189800|pmid=32109282|성3=Suzuki|이름3=Satoru}}</ref> type III fimbriae를 암호화하는 유전자는 conjugative-pilus-dependent biofilm 형성을 촉진하는 pOLA52(Klebsiella pneumoniae plasmid)에서 발견된다.<ref name=":4" /> |
|||
변환은 일반적으로 미생물막 내에서 발생한다. 연쇄상구균 종에서 세포벽 분해 효소가 방출되어 이웃 박테리아를 용해하고 DNA를 방출하는 fratricide라는 현상을 볼 수 있다. 이 DNA는 살아남은 박테리아에 의해 흡수(변환)될 수 있다. 능력 자극 펩티드는 S. pneumoniae와 S. mutans 사이에서도 미생물막 형성에 중요한 역할을 할 수 있다.<ref name=":4" /> V. cholerae 중에서, 능력 pilus 자체는 미생물막 형성 초기에 pilus-pilus 상호 작용을 통해 세포 응집을 촉진한다.<ref name=":4" /> |
|||
파지 침입은 미생물막 수명 주기에서 역할을 할 수 있으며, 박테리아를 용해하고 eDNA를 방출하여 미생물막 구조를 강화하고 형질전환 시 이웃 박테리아에 의해 흡수될 수 있다.<ref name=":4" /> E. coli phage Rac 및 P. aeruginosa prophage Pf4에 의한 미생물막 파괴는 미생물막에서 세포의 분리를 유발한다.<ref name=":4" /> 이와 같은 세포 박리는 더 많은 연구가 필요한 미생물막 관련 현상이지만, 미생물막을 구성하는 박테리아 종을 증식시키는 것으로 가정된다. |
|||
막 소포 HGT는 Neisseria gonorrhoeae, Pseudomonas aeruginosa, Helicobacter pylori 및 기타 많은 박테리아 종 중에서 해양 환경에서 발생하는 것으로 목격되었다.<ref name=":4" /> 막 소포 HGT가 미생물막 형성에 기여하는 인자로 밝혀졌음에도 불구하고 막 소포 매개 HGT가 미생물막 내에서 발생한다는 것을 증명하기 위해서는 여전히 연구가 필요하다.<ref name=":3" /><ref name=":4" /> 막 소포 HGT는 Bacillus subtilis SPP1 파지 내성 세포(SPP1 수용체 단백질 결핍)에서 파지-박테리아 상호작용을 조절하는 것으로 나타났다. 수용체를 포함하는 소포에 노출되면 pBT163(cat-encoding plasmid)의 형질도입이 발생하여 SPP1 수용체 단백질의 발현을 유발하여 수용 박테리아가 후의 파지 감염에 노출될 수 있다.<ref name=":4" /> |
|||
최근 연구에 따르면 고세균 종 H. volcanii는 세포-세포 접촉을 필요로 하고 세포질 가교 및 세포 융합 이벤트의 형성을 수반하는 분화 및 HGT와 같은 박테리아 미생물막과 유사한 일부 미생물막 표현형을 가지고 있다.<ref>{{저널 인용|제목=Biofilms formed by the archaeon Haloferax volcaniiexhibit cellular differentiation and social motility, and facilitate horizontal gene transfer|저널=BMC Biology|성=Chimileski|이름=Scott|성2=Franklin|이름2=Michael J|url=https://bmcbiol.biomedcentral.com/articles/10.1186/s12915-014-0065-5|날짜=2014-12|권=12|호=1|쪽=65|언어=en|doi=10.1186/s12915-014-0065-5|issn=1741-7007|성3=Papke|이름3=R Thane}}</ref> |
|||
== 같이 보기 == |
== 같이 보기 == |
||
* [[활성슬러지공법]] |
* [[활성슬러지공법]] |
||
== 외부 링크 == |
|||
| ⚫ | |||
| ⚫ | *공업화학 전망, 제14권 제5호, 2011, 생물학적 인 제거 기술 동향 및 발전 방향, 이은실⋅최창식,고등기술연구원 청정에너지팀, Technical Trend and Developmental Direction of Biological Phosphate RemovalEun Sil Lee†and Chang Sik ChoiClean Energy Team, Institute for Advanced Engineering)https://webcache.googleusercontent.com/search?q=cache:bj-COjteP0AJ:https://www.cheric.org/PDF/PIC/PC14/PC14-5-0030.pdf+&cd=1&hl=ko&ct=clnk&gl=kr |
||
== 각주 == |
== 각주 == |
||
| ⚫ | |||
{{각주}} |
{{각주}} |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | * |
||
{{전거 통제}} |
{{전거 통제}} |
||
2022년 10월 13일 (목) 12:06 판

미생물막(微生物膜, 영어: biofilm)은 미생물의 집합체로, 부착표면에 세포들이 서로 들러붙은 것을 말한다. 생물막(生物膜)이라고도 한다. 이러한 세포들은 종종 스스로 생산한 '세포 밖 고분자 물질'(EPS)의 망 내부에 조밀하게 끼워져 있다. 미생물막 EPS는 세포 외부의 유전자, 단백질, 다당류로 이루어진 고분자 복합체이다. 미생물막은 생물 또는 무생물의 표면에 형성될 수 있으며, 산업 시설이나 병원등 환경공학적으로 널리 사용될 수 있다.[1] 미생물막에서 자라는 미생물 균체는 생리학적으로 액체 배양액에 떠 있거나 헤엄치는 부유성 생물의 단일 세포 또는 활성슬러지(MLSS)와는 구별된다.
미생물들은 여러 요소들에 반응하여 미생물막을 형성하는데, 그 중에는 표면의 특정 또는 불특정 부착 부위의 세포의 인식. 영양 신호, 또는 경우에 따라서는 부유성 원생생물등을 포함하는 고착성 원생생물들이 환경에 노출되었을 때가 포함된다.[2][3]미생물막 박테리아는 영양분을 공유할 수 있으며 건조, 항생제 및 숙주 신체의 면역 체계와 같은 환경의 유해 요인으로부터 보호기능을 한다. 미생물막은 일반적으로 자유롭게 헤엄치는 박테리아가 표면에 부착될 때 형성되기 시작한다.[4]
기원과 형성
기원
미생물막은 원시 지구에서 원핵생물의 방어 메커니즘으로 발생했을 것으로 추정된다. 당시의 조건은 생존하기에 너무 가혹했기 때문이다. 그들은 지구 화석 기록(약 32억 5000만 년 전)에서 존재한 고세균과 박테리아로 매우 초기에 발견될 수 있으며 일반적으로 원핵 세포에 항상성을 제공하여 미생물막에서 세포 사이의 복잡한 상호 작용의 발달을 촉진하여 원핵 세포를 보호한다.[5]
형성
미생물막의 형성은 표면에 자유롭게 떠 있는 미생물의 부착으로 시작된다.[6][7] 미생물막의 첫 번째 콜로니 박테리아는 약한 반데르발스 힘과 소수성 효과에 의해 초기에 표면에 부착될 수 있다.[8][9] 콜로니의 균이 표면에서 즉시 분리되지 않으면 필리와 같은 세포 접착 구조를 사용하여 더 영구적으로 정착할 수 있다. 무산소 지하수에 서식하는 독특한 고세균군은 하미(hami)라고 불리는 유사한 구조를 가지고 있다. 각 하무스(hamus)는 서로 또는 표면에 부착하는 데 사용되는 3개의 갈고리 부착물이 있는 긴 튜브로 커뮤니티가 발전할 수 있도록 한다.[10] 고온성 고세균인 Pyrobaculum calidifontis는 박테리아 미생물막 안정성에 기여하는 박테리아 미생물막의 세포외 기질의 주요 구성요소인 박테리아 TasA 필라멘트와 상동인 번들링 필리를 생성한다.[11] TasA 상동체는 다른 많은 고세균에 의해 암호화되어 있으며, 이는 세균과 고세균 미생물막 사이의 기계적 유사성과 진화적 연결을 시사한다.[11]
소수성은 또한 박테리아가 미생물막을 형성하는 능력에 영향을 줄 수 있다. 증가된 소수성을 가진 박테리아는 기질과 박테리아 사이의 반발력을 감소시켰다.[12] 일부 박테리아 종은 제한된 운동성으로 인해 자체적으로 표면에 성공적으로 부착할 수 없지만 대신 매트릭스에 스스로를 고정하거나 다른 초기 박테리아 콜로니에 직접 고정할 수 있다. 비운동성 박테리아는 운동성 박테리아만큼 쉽게 표면을 인식하거나 함께 뭉칠 수 없다.[12]
표면 집락화 동안 박테리아 세포는 N-아실 호모세린 락톤(AHL)과 같은 정족수 감지(QS) 제품을 사용하여 통신할 수 있다. 일단 콜로니화가 시작되면 미생물막은 세포 분열과 모집의 조합에 의해 성장한다. 다당류 매트릭스는 일반적으로 박테리아 미생물막을 둘러싸고 있다. 기질 엑소폴리사카라이드는 포식자 탐지를 방지하고 박테리아 생존을 보장하기 위해 미생물막 내에 QS 자가유도제를 가둘 수 있다.[13] 다당류 외에도 이러한 매트릭스에는 미네랄, 토양 입자 및 적혈구 및 섬유소와 같은 혈액 성분을 포함하지만 이에 국한되지 않는 주변 환경의 물질이 포함될 수 있다.[12] 미생물막 형성의 마지막 단계는 분산으로 알려져 있으며 미생물막이 형성되고 모양과 크기만 변할 수 있는 단계이다.
미생물막의 발달은 응집 세포 군체(또는 군체)가 점점 더 내성이 생기거나[14] 항생제에 내성을 갖도록 할 수 있다. 세포 간 통신 또는 정족수 감지는 여러 박테리아 종에서 미생물막 형성에 관여하는 것으로 나타났다.[15]
개발
미생물막은 미생물 발달 과정의 산물이다.[16] 이 과정은 아래 다이어그램과 같이 미생물막 개발의 5가지 주요 단계로 요약된다.[17]

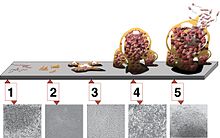
분산
미생물막 콜로니에서 세포의 분산은 미생물막 수명 주기의 필수 단계이다. 분산은 미생물막이 새로운 표면을 퍼뜨리고 콜로니화할 수 있도록 한다. dispersin B 및 deoxyribonuclease와 같은 미생물막 세포외 기질을 분해하는 효소는 미생물막 분산에 기여할 수 있다.[21][22] 미생물막 기질을 분해하는 효소는 항미생물막 제제로 유용할 수 있다.[23][24] 증거에 따르면 지방산 메신저인 cis-2-decenoic acid는 분산을 유도하고 미생물막 집락의 성장을 억제할 수 있다. 녹농균(Pseudomonas aeruginosa)에 의해 분비되는 이 화합물은 여러 종의 박테리아와 효모 칸디다 알비칸스(Candida albicans)에서 사이클로 이형 세포를 유도한다.[25] 산화질소는 또한 독성이 없는 농도에서 여러 박테리아 종[26][27]의 미생물막 분산을 유발하는 것으로 나타났다. 산화질소는 미생물막으로 인한 만성 감염이 있는 환자의 치료제로 잠재력이 있다.[28]
일반적으로 미생물막에서 분산된 세포는 즉시 플랑크톤 성장 단계에 들어간다고 가정했다. 그러나 연구에 따르면 녹농균(Pseudomonas aeruginosa) 미생물막에서 분산된 세포의 생리학은 플랑크톤 및 미생물막 세포의 생리학과 크게 다르다.[29][30] 따라서 분산 과정은 미생물막에서 박테리아의 플랑크톤 생활 방식으로 전환하는 동안 독특한 단계이다. 분산된 세포는 대식세포와 Caenorhabditis elegans에 대해 독성이 높지만 플랑크톤 세포에 비해 철 스트레스에 매우 민감한 것으로 밝혀졌다.[29]
속성
미생물막은 일반적으로 수용액에 잠겨 있거나 수용액에 노출된 고체 기질에서 발견되지만 특히 습도가 높은 기후에서는 액체 표면과 잎 표면에 떠 있는 매트로 형성될 수 있다. 성장을 위한 충분한 자원이 주어지면 미생물막은 육안으로 볼 수 있는 거시적으로 빠르게 성장할 것이다. 미생물막에는 다양한 유형의 미생물이 포함될 수 있다. 박테리아, 고세균, 원생동물, 균류 및 조류 등의 각 그룹은 특수 대사 기능을 수행한다. 그러나 일부 유기체는 특정 조건에서 단일 종만으로 필름을 형성한다. 미생물막 내의 사회 구조(협력/경쟁)는 기존에 존재한 다른 종에 크게 의존한다.[31]
세포외 기질
세포외기질은 엑소폴리사카라이드, 단백질 및 핵산으로 구성된다.[32][33][34] EPS의 많은 부분이 다소 강하게 수화되지만 소수성 EPS도 발생한다. 한 가지 예는 다양한 미생물에 의해 생산되는 셀룰로오스[35]이다. 이 매트릭스는 그 안에 있는 세포를 감싸고 생화학적 신호와 유전자 교환을 통해 세포 간의 의사 소통을 촉진한다. EPS 매트릭스는 또한 세포외 효소를 포획하여 세포에 가깝게 유지한다. 따라서 매트릭스는 외부 소화 시스템을 나타내며 다른 종의 안정적인 시너지 마이크로컨소시엄을 허용한다.[36] 일부 미생물막은 영양분과 신호 분자를 분배하는 데 도움이 되는 수로를 포함하는 것으로 밝혀졌다.[37] 이 매트릭스는 특정 조건에서 미생물막이 화석화될 수 있을 만큼 충분히 강하다(스트로마톨라이트).
미생물막에 서식하는 박테리아는 일반적으로 동일한 종의 자유 부유 박테리아와 상당히 다른 특성을 가지고 있다. 막의 조밀하고 보호된 환경에서 다양한 방식으로 협력하고 상호 작용할 수 있기 때문이다.[38] 이 환경의 한 가지 이점은 조밀한 세포외 기질과 세포의 외부층이 공동체 내부를 보호하기 때문에 세제와 항생제에 대한 내성이 증가한다는 것이다.[39][40] 어떤 경우에는 항생제 내성이 5,000배까지 증가할 수 있다.[41] 측면 유전자 전달은 종종 세균 및 고세균 미생물막 내에서 촉진되고[42] 보다 안정적인 미생물막 구조로 이어진다.[43] 세포외 DNA는 다양한 미생물 미생물막의 주요 구조적 구성요소이다.[44] 세포외 DNA의 효소적 분해는 미생물막 구조를 약화시키고 표면에서 미생물 세포를 방출할 수 있다.
그러나 미생물막이 항상 항생제에 덜 민감한 것은 아니다. 예를 들어, 녹농균(Pseudomonas aeruginosa)의 미생물막 형태는 고정상 플랑크톤 세포보다 항균제에 대한 내성이 크지 않지만, 미생물막이 대수상 플랑크톤 세포와 비교할 때 미생물막은 항균제에 대한 내성이 더 크다. 정지상 세포와 미생물막 모두에서 항생제에 대한 이러한 내성은 지속 세포의 존재 때문일 수 있다.[45]
활용
이 문단의 내용은 출처가 분명하지 않습니다. |
미생물막(生物膜,Biofilm)은 환경공학에서 미생물이 주된 구성 요소가 되어 생성된 막을 가리킨다. 하,폐수에서 오염 물질을 처리하는 데 사용된다.
미생물막법(生物膜法, Bio-membrane process)은 배수 중 유기물을 분해하거나 제거하기 위해 운반체 표면에 필름 모양으로 미생물을 부착하는 하수 처리 방법이다. HBC, 회전 원판법이나 살수 여상법이 여기에 속한다. 미생물막 표면에서는 호기성 처리가, 내부에서는 혐기성 처리가 이루어진다.
원생생물
보티셀라(vorticella)같은 원생생물 등이 주요하게 이를 형성한다.
수평적 유전자 전달
수평적 유전자 전달은 세포 유기체 사이의 유전 물질 전달 방법이다. 원핵 생물에서 자주 발생하고 진핵 생물에서는 덜 발생한다. 박테리아에서 수평적 유전자 전달은 형질전환(환경에서 자유 부유 DNA의 흡수), 형질도입(바이러스 매개 DNA 흡수) 또는 접합(두 인접 박테리아의 선모 구조 사이의 DNA 전달)을 통해 발생할 수 있다.[156] 최근 연구에서는 막 소포 전달 또는 유전자 전달제와 같은 다른 메커니즘도 밝혀냈다.[46] 미생물막은 다양한 방식으로 수평적 유전자 전달을 촉진한다.
미생물막은 접합을 촉진하여 많은 미생물막의 다양한 이질성으로 인해 종종 종간 이동을 촉진한다. 또한, 미생물막은 다당류 매트릭스에 의해 구조적으로 제한되어 접합을 위한 긴밀한 공간 요구 사항을 제공한다. 형질전환은 미생물막에서도 자주 관찰된다. 박테리아 자가분해는 미생물막 구조 조절의 핵심 메커니즘으로, 변형 흡수를 위해 준비된 유능한 DNA의 풍부한 소스를 제공한다.[46][47] 어떤 경우에는 미생물막 간 정족수 감지가 자유 부동 eDNA의 능력을 향상시켜 형질전환을 더욱 촉진할 수 있다.[46] 박테리오파지 운반체를 통한 Stx 유전자 전달은 미생물막 내에서 목격되었으며, 이는 미생물막이 형질도입에 적합한 환경임을 시사한다.[46] 막 소포 HGT는 방출된 막 소포(유전 정보 포함)가 수용 박테리아와 융합하고 유전 물질을 박테리아의 세포질로 방출할 때 발생한다.[46] 최근 연구에 따르면 막 소포 HGT가 단일 균주 미생물막 형성을 촉진할 수 있지만 막 소포 HGT가 다중 균주 미생물막 형성에서 수행하는 역할은 아직 알려져 있지 않다. GTA 또는 유전자 전달제는 숙주 박테리아에 의해 생성되는 파지 같은 입자이며 숙주 박테리아 게놈에서 무작위 DNA 단편을 포함한다.[46] 미생물막 내의 HGT는 미생물막 개체군 전체에 항생제 내성 또는 증가된 병원성을 부여하여 미생물막 항상성을 촉진할 수 있다.[46]
예시
접합 플라스미드는 세포 접착을 촉진하는 PtgA, PrgB 또는 PrgC와 같은 미생물막 관련 단백질을 암호화 할 수 있다(조기 미생물막 형성에 필요).[48] type III fimbriae를 암호화하는 유전자는 conjugative-pilus-dependent biofilm 형성을 촉진하는 pOLA52(Klebsiella pneumoniae plasmid)에서 발견된다.[48]
변환은 일반적으로 미생물막 내에서 발생한다. 연쇄상구균 종에서 세포벽 분해 효소가 방출되어 이웃 박테리아를 용해하고 DNA를 방출하는 fratricide라는 현상을 볼 수 있다. 이 DNA는 살아남은 박테리아에 의해 흡수(변환)될 수 있다. 능력 자극 펩티드는 S. pneumoniae와 S. mutans 사이에서도 미생물막 형성에 중요한 역할을 할 수 있다.[48] V. cholerae 중에서, 능력 pilus 자체는 미생물막 형성 초기에 pilus-pilus 상호 작용을 통해 세포 응집을 촉진한다.[48]
파지 침입은 미생물막 수명 주기에서 역할을 할 수 있으며, 박테리아를 용해하고 eDNA를 방출하여 미생물막 구조를 강화하고 형질전환 시 이웃 박테리아에 의해 흡수될 수 있다.[48] E. coli phage Rac 및 P. aeruginosa prophage Pf4에 의한 미생물막 파괴는 미생물막에서 세포의 분리를 유발한다.[48] 이와 같은 세포 박리는 더 많은 연구가 필요한 미생물막 관련 현상이지만, 미생물막을 구성하는 박테리아 종을 증식시키는 것으로 가정된다.
막 소포 HGT는 Neisseria gonorrhoeae, Pseudomonas aeruginosa, Helicobacter pylori 및 기타 많은 박테리아 종 중에서 해양 환경에서 발생하는 것으로 목격되었다.[48] 막 소포 HGT가 미생물막 형성에 기여하는 인자로 밝혀졌음에도 불구하고 막 소포 매개 HGT가 미생물막 내에서 발생한다는 것을 증명하기 위해서는 여전히 연구가 필요하다.[46][48] 막 소포 HGT는 Bacillus subtilis SPP1 파지 내성 세포(SPP1 수용체 단백질 결핍)에서 파지-박테리아 상호작용을 조절하는 것으로 나타났다. 수용체를 포함하는 소포에 노출되면 pBT163(cat-encoding plasmid)의 형질도입이 발생하여 SPP1 수용체 단백질의 발현을 유발하여 수용 박테리아가 후의 파지 감염에 노출될 수 있다.[48]
최근 연구에 따르면 고세균 종 H. volcanii는 세포-세포 접촉을 필요로 하고 세포질 가교 및 세포 융합 이벤트의 형성을 수반하는 분화 및 HGT와 같은 박테리아 미생물막과 유사한 일부 미생물막 표현형을 가지고 있다.[49]
같이 보기
외부 링크
- (우리말샘) 미생물막 등
- 공업화학 전망, 제14권 제5호, 2011, 생물학적 인 제거 기술 동향 및 발전 방향, 이은실⋅최창식,고등기술연구원 청정에너지팀, Technical Trend and Developmental Direction of Biological Phosphate RemovalEun Sil Lee†and Chang Sik ChoiClean Energy Team, Institute for Advanced Engineering)https://webcache.googleusercontent.com/search?q=cache:bj-COjteP0AJ:https://www.cheric.org/PDF/PIC/PC14/PC14-5-0030.pdf+&cd=1&hl=ko&ct=clnk&gl=kr
각주
- ↑ Hall-Stoodley L, Costerton JW, Stoodley P (2004년 2월). “Bacterial biofilms: from the natural environment to infectious diseases”. 《Nature|Nature Reviews. Microbiology》 2 (2): 95~108. doi:10.1038/nrmicro821. PMID 15040259.
- ↑ Karatan E, Watnick P (2009년 6월). “Signals, regulatory networks, and materials that build and break bacterial biofilms”. 《Microbiology and Molecular Biology Reviews》 73 (2): 310~47. doi:10.1128/MMBR.00041-08. PMC 2698413. PMID 19487730.
- ↑ Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI (2005년 8월). “Aminoglycoside antibiotics induce bacterial biofilm formation”. 《Nature》 436 (7054): 1171~5. doi:10.1038/nature03912. PMID 16121184.
- ↑ Case C, Funke B, Tortora G. Microbiology An Introduction (tenth ed.)
- ↑ Hall-Stoodley, Luanne; Costerton, J. William; Stoodley, Paul (2004년 2월). “Bacterial biofilms: from the Natural environment to infectious diseases”. 《Nature Reviews Microbiology》 (영어) 2 (2): 95–108. doi:10.1038/nrmicro821. ISSN 1740-1526.
- ↑ Watnick, Paula; Kolter, Roberto (2000년 5월 15일). “Biofilm, City of Microbes”. 《Journal of Bacteriology》 (영어) 182 (10): 2675–2679. doi:10.1128/JB.182.10.2675-2679.2000. ISSN 0021-9193. PMC 101960. PMID 10781532.
- ↑ O'Toole, George A.; Kolter, Roberto (1998년 4월). “Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis”. 《Molecular Microbiology》 (영어) 28 (3): 449–461. doi:10.1046/j.1365-2958.1998.00797.x. ISSN 0950-382X.
- ↑ Briandet, R; Herry, J.-M; Bellon-Fontaine, M.-N (2001년 8월). “Determination of the van der Waals, electron donor and electron acceptor surface tension components of static Gram-positive microbial biofilms”. 《Colloids and Surfaces B: Biointerfaces》 (영어) 21 (4): 299–310. doi:10.1016/S0927-7765(00)00213-7.
- ↑ Takahashi, H.; Suda, T.; Tanaka, Y.; Kimura, B. (2010년 3월 22일). “Cellular hydrophobicity of Listeria monocytogenes involves initial attachment and biofilm formation on the surface of polyvinyl chloride: Cellular properties and biofilm formation of L. monocytogenes”. 《Letters in Applied Microbiology》 (영어) 50 (6): 618–625. doi:10.1111/j.1472-765X.2010.02842.x.
- ↑ Madigan, Michael T. (2019). 《Brock biology of microorganisms》 Fifteen, Global판. NY, NY. 86쪽. ISBN 978-1-292-23510-3.
- ↑ 가 나 Wang, Fengbin; Cvirkaite-Krupovic, Virginija; Krupovic, Mart; Egelman, Edward H. (2022년 6월 28일). “Archaeal bundling pili of Pyrobaculum calidifontis reveal similarities between archaeal and bacterial biofilms”. 《Proceedings of the National Academy of Sciences》 (영어) 119 (26): e2207037119. doi:10.1073/pnas.2207037119. ISSN 0027-8424. PMC 9245690. PMID 35727984.
- ↑ 가 나 다 Donlan, Rodney M. (2002년 9월). “Biofilms: Microbial Life on Surfaces”. 《Emerging Infectious Diseases》 8 (9): 881–890. doi:10.3201/eid0809.020063. ISSN 1080-6040. PMC 2732559. PMID 12194761.
- ↑ Li, Shaoyang; Liu, Sylvia Yang; Chan, Shepherd Yuen; Chua, Song Lin (2022년 5월). “Biofilm matrix cloaks bacterial quorum sensing chemoattractants from predator detection”. 《The ISME Journal》 (영어) 16 (5): 1388–1396. doi:10.1038/s41396-022-01190-2. ISSN 1751-7362. PMC 9038794. PMID 35034106.
- ↑ Ciofu, Oana; Tolker-Nielsen, Tim (2019년 5월 3일). “Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial Agents—How P. aeruginosa Can Escape Antibiotics”. 《Frontiers in Microbiology》 10: 913. doi:10.3389/fmicb.2019.00913. ISSN 1664-302X. PMC 6509751. PMID 31130925.
- ↑ Sakuragi, Yumiko; Kolter, Roberto (2007년 7월 15일). “Quorum-Sensing Regulation of the Biofilm Matrix Genes ( pel ) of Pseudomonas aeruginosa”. 《Journal of Bacteriology》 (영어) 189 (14): 5383–5386. doi:10.1128/JB.00137-07. ISSN 0021-9193. PMC 1951888. PMID 17496081.
- ↑ O'Toole, George; Kaplan, Heidi B.; Kolter, Roberto (2000년 10월). “Biofilm Formation as Microbial Development”. 《Annual Review of Microbiology》 (영어) 54 (1): 49–79. doi:10.1146/annurev.micro.54.1.49. ISSN 0066-4227.
- ↑ Monroe, Don (2007년 11월 13일). “Looking for Chinks in the Armor of Bacterial Biofilms”. 《PLoS Biology》 (영어) 5 (11): e307. doi:10.1371/journal.pbio.0050307. ISSN 1545-7885. PMC 2071939. PMID 18001153.
- ↑ 가 나 Rapacka-Zdonczyk A, Wozniak A, Nakonieczna J, Grinholc M (February 2021). “Development of Antimicrobial Phototreatment Tolerance: Why the Methodology Matters”. 《International Journal of Molecular Sciences》 (MDPI AG) 22 (4): 2224. doi:10.3390/ijms22042224. PMC 7926562. PMID 33672375.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ Hall CW, Mah TF (May 2017). “Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria”. 《FEMS Microbiology Reviews》 (Oxford University Press (OUP)) 41 (3): 276–301. doi:10.1093/femsre/fux010. PMID 28369412.
- ↑ 인용 오류:
<ref>태그가 잘못되었습니다;Monroe2007라는 이름을 가진 주석에 텍스트가 없습니다 - ↑ Kaplan, Jeffrey B.; Ragunath, Chandran; Ramasubbu, Narayanan; Fine, Daniel H. (2003년 8월 15일). “Detachment of Actinobacillus actinomycetemcomitans Biofilm Cells by an Endogenous β-Hexosaminidase Activity”. 《Journal of Bacteriology》 (영어) 185 (16): 4693–4698. doi:10.1128/JB.185.16.4693-4698.2003. ISSN 0021-9193. PMC 166467. PMID 12896987.
- ↑ Izano, Era A.; Amarante, Matthew A.; Kher, William B.; Kaplan, Jeffrey B. (2008년 1월 15일). “Differential Roles of Poly- N -Acetylglucosamine Surface Polysaccharide and Extracellular DNA in Staphylococcus aureus and Staphylococcus epidermidis Biofilms”. 《Applied and Environmental Microbiology》 (영어) 74 (2): 470–476. doi:10.1128/AEM.02073-07. ISSN 0099-2240. PMC 2223269. PMID 18039822.
- ↑ Kaplan, Jeffrey B.; Ragunath, Chandran; Velliyagounder, Kabilan; Fine, Daniel H.; Ramasubbu, Narayanan (2004년 7월). “Enzymatic Detachment of Staphylococcus epidermidis Biofilms”. 《Antimicrobial Agents and Chemotherapy》 (영어) 48 (7): 2633–2636. doi:10.1128/AAC.48.7.2633-2636.2004. ISSN 0066-4804.
- ↑ Xavier, Joao B.; Picioreanu, Cristian; Rani, Suriani Abdul; van Loosdrecht, Mark C. M.; Stewart, Philip S. (2005년 12월 1일). “Biofilm-control strategies based on enzymic disruption of the extracellular polymeric substance matrix – a modelling study”. 《Microbiology》 (영어) 151 (12): 3817–3832. doi:10.1099/mic.0.28165-0. ISSN 1350-0872.
- ↑ Davies, David G.; Marques, Cláudia N. H. (2009년 3월). “A Fatty Acid Messenger Is Responsible for Inducing Dispersion in Microbial Biofilms”. 《Journal of Bacteriology》 (영어) 191 (5): 1393–1403. doi:10.1128/JB.01214-08. ISSN 0021-9193. PMC 2648214. PMID 19074399.
- ↑ Barraud, Nicolas ; Hassett, Daniel J.; Hwang, Sung-Hei; Rice, Scott A.; Kjelleberg, Staffan; Webb, Jeremy S. (2006년 11월). “Involvement of Nitric Oxide in Biofilm Dispersal of Pseudomonas aeruginosa”. 《Journal of Bacteriology》 (영어) 188 (21): 7344–7353. doi:10.1128/JB.00779-06. ISSN 0021-9193. PMC 1636254. PMID 17050922.
- ↑ Barraud, Nicolas; Storey, Michael V.; Moore, Zoe P.; Webb, Jeremy S.; Rice, Scott A.; Kjelleberg, Staffan (2009년 5월). “Nitric oxide-mediated dispersal in single- and multi-species biofilms of clinically and industrially relevant microorganisms: NO-mediated dispersal in bacterial biofilms”. 《Microbial Biotechnology》 (영어) 2 (3): 370–378. doi:10.1111/j.1751-7915.2009.00098.x. PMC 3815757. PMID 21261931.
- ↑ “Dispersal of Biofilms in Cystic Fibrosis | Biological Sciences | University of Southampton”. 2022년 10월 13일에 확인함.
- ↑ 가 나 Chua, Song Lin; Liu, Yang; Yam, Joey Kuok Hoong; Chen, Yicai; Vejborg, Rebecca Munk; Tan, Bryan Giin Chyuan; Kjelleberg, Staffan; Tolker-Nielsen, Tim; Givskov, Michael (2014년 12월 17일). “Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles”. 《Nature Communications》 (영어) 5 (1): 4462. doi:10.1038/ncomms5462. ISSN 2041-1723.
- ↑ Chua, Song Lin; Hultqvist, Louise D; Yuan, Mingjun; Rybtke, Morten; Nielsen, Thomas E; Givskov, Michael; Tolker-Nielsen, Tim; Yang, Liang (2015년 8월). “In vitro and in vivo generation and characterization of Pseudomonas aeruginosa biofilm–dispersed cells via c-di-GMP manipulation”. 《Nature Protocols》 (영어) 10 (8): 1165–1180. doi:10.1038/nprot.2015.067. ISSN 1754-2189.
- ↑ Nadell, Carey D.; Xavier, Joao B.; Foster, Kevin R. (2009년 1월). “The sociobiology of biofilms”. 《FEMS Microbiology Reviews》 (영어) 33 (1): 206–224. doi:10.1111/j.1574-6976.2008.00150.x. ISSN 1574-6976.
- ↑ Rybtke, Morten; Hultqvist, Louise Dahl; Givskov, Michael; Tolker-Nielsen, Tim (2015년 11월). “Pseudomonas aeruginosa Biofilm Infections: Community Structure, Antimicrobial Tolerance and Immune Response”. 《Journal of Molecular Biology》 (영어) 427 (23): 3628–3645. doi:10.1016/j.jmb.2015.08.016.
- ↑ Danese, Paul N.; Pratt, Leslie A.; Kolter, Roberto (2000년 6월 15일). “Exopolysaccharide Production Is Required for Development of Escherichia coli K-12 Biofilm Architecture”. 《Journal of Bacteriology》 (영어) 182 (12): 3593–3596. doi:10.1128/JB.182.12.3593-3596.2000. ISSN 0021-9193. PMC 101973. PMID 10852895.
- ↑ Branda, Steven S.; Chu, Frances; Kearns, Daniel B.; Losick, Richard; Kolter, Roberto (2006년 2월). “A major protein component of the Bacillus subtilis biofilm matrix”. 《Molecular Microbiology》 (영어) 59 (4): 1229–1238. doi:10.1111/j.1365-2958.2005.05020.x. ISSN 0950-382X.
- ↑ Choong, Ferdinand X; Bäck, Marcus; Fahlén, Sara; Johansson, Leif BG; Melican, Keira; Rhen, Mikael; Nilsson, K Peter R; Richter-Dahlfors, Agneta (2016년 11월). “Real-time optotracing of curli and cellulose in live Salmonella biofilms using luminescent oligothiophenes”. 《npj Biofilms and Microbiomes》 (영어) 2 (1): 16024. doi:10.1038/npjbiofilms.2016.24. ISSN 2055-5008. PMC 5515270. PMID 28721253.
- ↑ Flemming, Hans-Curt; Wingender, Jost; Szewzyk, Ulrich; Steinberg, Peter; Rice, Scott A.; Kjelleberg, Staffan (2016년 9월). “Biofilms: an emergent form of bacterial life”. 《Nature Reviews Microbiology》 (영어) 14 (9): 563–575. doi:10.1038/nrmicro.2016.94. ISSN 1740-1526.
- ↑ Stoodley, Paul; deBeer, Dirk; Lewandowski, Zbigniew (1994년 8월). “Liquid Flow in Biofilm Systems”. 《Applied and Environmental Microbiology》 (영어) 60 (8): 2711–2716. doi:10.1128/aem.60.8.2711-2716.1994. ISSN 0099-2240. PMC 201713. PMID 16349345.
- ↑ Vlamakis, Hera; Aguilar, Claudio; Losick, Richard; Kolter, Roberto (2008년 4월 1일). “Control of cell fate by the formation of an architecturally complex bacterial community”. 《Genes & Development》 (영어) 22 (7): 945–953. doi:10.1101/gad.1645008. ISSN 0890-9369. PMC 2279205. PMID 18381896.
- ↑ Stewart, Philip S; William Costerton, J (2001년 7월). “Antibiotic resistance of bacteria in biofilms”. 《The Lancet》 (영어) 358 (9276): 135–138. doi:10.1016/S0140-6736(01)05321-1.
- ↑ Pandey, Rosy; Mishra, Shyam Kumar; Shrestha, Angela (2021년 6월). “Characterisation of ESKAPE Pathogens with Special Reference to Multidrug Resistance and Biofilm Production in a Nepalese Hospital”. 《Infection and Drug Resistance》 (영어). Volume 14: 2201–2212. doi:10.2147/IDR.S306688. ISSN 1178-6973.
- ↑ Del Pozo, J. L.; Rouse, M. S.; Patel, R. (2008년 9월). “Bioelectric Effect and Bacterial Biofilms. a Systematic Review”. 《The International Journal of Artificial Organs》 (영어) 31 (9): 786–795. doi:10.1177/039139880803100906. ISSN 0391-3988. PMC 3910516. PMID 18924090.
- ↑ Chimileski, Scott; Franklin, Michael J; Papke, R Thane (2014년 12월). “Biofilms formed by the archaeon Haloferax volcaniiexhibit cellular differentiation and social motility, and facilitate horizontal gene transfer”. 《BMC Biology》 (영어) 12 (1): 65. doi:10.1186/s12915-014-0065-5. ISSN 1741-7007.
- ↑ Molin, Søren; Tolker-Nielsen, Tim (2003년 6월). “Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure”. 《Current Opinion in Biotechnology》 (영어) 14 (3): 255–261. doi:10.1016/S0958-1669(03)00036-3.
- ↑ Jakubovics, N.S.; Shields, R.C.; Rajarajan, N.; Burgess, J.G. (2013년 12월). “Life after death: the critical role of extracellular DNA in microbial biofilms”. 《Letters in Applied Microbiology》 (영어) 57 (6): 467–475. doi:10.1111/lam.12134.
- ↑ Spoering, Amy L.; Lewis, Kim (2001년 12월). “Biofilms and Planktonic Cells of Pseudomonas aeruginosa Have Similar Resistance to Killing by Antimicrobials”. 《Journal of Bacteriology》 (영어) 183 (23): 6746–6751. doi:10.1128/JB.183.23.6746-6751.2001. ISSN 0021-9193. PMC 95513. PMID 11698361.
- ↑ 가 나 다 라 마 바 사 아 Luo, Aihua; Wang, Fang; Sun, Degang; Liu, Xueyu; Xin, Bingchang (2022년 1월 4일). “Formation, Development, and Cross-Species Interactions in Biofilms”. 《Frontiers in Microbiology》 12: 757327. doi:10.3389/fmicb.2021.757327. ISSN 1664-302X. PMC 8764401. PMID 35058893.
- ↑ Thomas, Vinai Chittezham; Hancock, Lynn E. (2009년 9월). “Suicide and Fratricide in Bacterial Biofilms”. 《The International Journal of Artificial Organs》 (영어) 32 (9): 537–544. doi:10.1177/039139880903200902. ISSN 0391-3988.
- ↑ 가 나 다 라 마 바 사 아 자 Abe, Kimihiro; Nomura, Nobuhiko; Suzuki, Satoru (2020년 5월 1일). “Biofilms: hot spots of horizontal gene transfer (HGT) in aquatic environments, with a focus on a new HGT mechanism”. 《FEMS Microbiology Ecology》 (영어) 96 (5): fiaa031. doi:10.1093/femsec/fiaa031. ISSN 0168-6496. PMC 7189800. PMID 32109282.
- ↑ Chimileski, Scott; Franklin, Michael J; Papke, R Thane (2014년 12월). “Biofilms formed by the archaeon Haloferax volcaniiexhibit cellular differentiation and social motility, and facilitate horizontal gene transfer”. 《BMC Biology》 (영어) 12 (1): 65. doi:10.1186/s12915-014-0065-5. ISSN 1741-7007.
