스타부딘: 두 판 사이의 차이
일부 문서 해석 |
(차이 없음)
|
2021년 6월 11일 (금) 22:19 판
| |
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
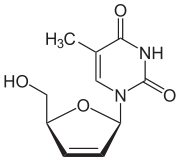
| 1-[(2R,5S)-5-(hydroxymethyl)-2,5-dihydrofuran-2-yl]-5-methyl-1,2,3,4-tetrahydropyrimidine-2,4-dione | |
| 식별 정보 | |
| CAS 등록번호 | 3056-17-5 |
| ATC 코드 | J05AF04 |
| PubChem | 18283 |
| 드러그뱅크 | DB00649 |
| ChemSpider | 17270 |
| 화학적 성질 | |
| 화학식 | C10H12N2O4 |
| 분자량 | ? |
| 유의어 | 2′,3′-didehydro-2′,3′-dideoxythymidine |
| 약동학 정보 | |
| 생체적합성 | >80% |
| 단백질 결합 | Negligible |
| 동등생물의약품 | ? |
| 약물 대사 | Kidney elimination (~40%) |
| 생물학적 반감기 | 0.8–1.5 hours (in adults) |
| 배출 | ? |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아)C(미국) |
| 법적 상태 | |
| 투여 방법 | By mouth |
스타부딘(d4T)는 제리트(Zerit)라는 상품명으로 판매되고 있으며, 후천성 면역 결핍증(HIV/AIDS)을 예방 및 치료하는데 사용되는 고정 용량의 항레트로바이러스 복합제제이다.[3] 이 약물은 다른 항레트로바이러스제와 함께 사용하도록 권고되고 있다.[3] 주사기와 같은 날카로운 바늘에 찔리거나 이외의 잠재적으로 바이러스에 노출된 것으로 보일 때 예방 차원에서 사용될 수 있다. 하지만 이 약물은 1차 치료제로 사용되지 않으며[3] 경구로 복용한다.[3]
흔한 부작용으로는 두통, 설사, 구토, 발진과 말초신경장애가 있다.[3] 심각한 이상반응으로는 고젖산혈증, 췌장염과 비대해진 간이 있다.[3] 임신 중의 사용은 권장되지 않는다.[3] 스타부딘은 뉴클레오시드 유사체 역전사효소 억제제(NRTI) 계열의 약물이다.[3]
스타부딘은 1966년 처음 등장했으며, 1994년 미국에서 사용 승인을 받았다.[4] 제네릭 의약품으로 판매되고 있다.[3]
의학적 사용/용도
스타부딘은 HIV-1 감염 시 사용하는 약물이지만, 증상 및 상태가 호전될 뿐 완치를 해주지는 못한다. 그 결과 일반적으로 일차 치료제로 권장되지 않는다.[5] 스타부딘은 업무 중(ex. 주사바늘) 혹은 감염된 혈액이나 체액의 접촉을 통해 바이러스에 노출되었을 때 HIV-1 감염으로의 발전 가능성을 줄일 수 있다.[6] 스타부딘은 HIV 감염 시의 상태를 조절하고, 합병증으로의 진행을 줄이기 위해 다른 HIV 치료제와 병용하는 방식으로 사용된다.[7]
세계보건기구(WHO)는 스타부딘의 독성이 매우 심각하다는 점을 고려해 시장에서 이 약물의 퇴출을 주장하고 있다. 그럼에도 불구하고 약물의 사용이 불가피하다면, 부작용의 빈도를 줄이기 위해 저용량을 사용하도록 권장하고 있다. 하지만 2015년 Cochrane review에서 관찰한 결과 고용량 용법과 저용량 용법 사이에 특별한 차이점을 찾지 못했다.[8]
임신과 수유
스타부딘은 동물실험 결과 태아에게 영향을 미침을 보였으나 사람을 대상으로 한 임상실험에서는 데이터가 밝혀지지 않았다.
소아
태아가 태어난 시기부터 청소년기에 해당하는 연령대까지의 소아 및 청소년에서 스타부딘의 사용은 안전하다. 약물 사용 시의 이상반응과 안전에 관한 사항은 성인에서와 동일하다.[1]
노인
HIV에 감염된 65세 이상 성인(노인)에서의 스타부딘 사용에 대한 데이터가 없다. 하지만 65세 이상의 환자 12000명 중 30%에 해당하는 환자가 이 약물을 복용했을 때 말초신경병증을 경험하였다.[1] 또한 노인의 경우 대부분 신장의 기능이 떨어져 있는 경향을 보이기 때문에 독성에 더 취약하고 심각한 부작용이 발생할 가능성이 매우 높다.[9]
이상반응
흔한 부작용[1]
- 구역
- 구토
- 설사
- 두통
- 위장관 불편함
심각한 부작용/이상반응[1]
- 말초신경병증
- 젖산산증
- 췌장염
- 간독성
- 간섬유화를 동반한 간비대
- 지방위축증/지질영양이상증 (지방 재분포/축적)
- ↑ 가 나 다 라 마 “Stavudine capsule”. 《DailyMed》. 2019년 9월 21일. 2020년 10월 13일에 확인함.
- ↑ “Zerit EPAR”. 《European Medicines Agency (EMA)》. 2020년 10월 13일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 “Stavudine Monograph for Professionals - Drugs.com”. 《www.drugs.com》. 2016년 11월 10일에 원본 문서에서 보존된 문서. 2016년 11월 9일에 확인함.
- ↑ Fischer, Janos; Ganellin, C. Robin (2006). 《Analogue-based Drug Discovery》 (영어). John Wiley & Sons. 505쪽. ISBN 9783527607495. 2017년 9월 8일에 원본 문서에서 보존된 문서.
- ↑ “Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV—United States, 2016” (PDF). 《Center for Disease Control and Prevention》. Annals of Emergency Medicine. 2016년 11월 20일에 원본 문서 (PDF)에서 보존된 문서. 2016년 8월 11일에 확인함.
- ↑ “Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents” (PDF). Panel on Antiretroviral Guidelines for Adults and Adolescents, US Department of Health and Human Services (HHS). 2016년 11월 1일에 원본 문서 (PDF)에서 보존된 문서. 2016년 8월 11일에 확인함.
- ↑ Bristol-Myers Squibb (December 2012). “Zerit (stavudine) capsules and powder for oral solution prescribing information” (PDF). Princeton, NJ. 2017년 1월 31일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Magula, N; Dedicoat, M (2015년 1월 28일). “Low dose versus high dose stavudine for treating people with HIV infection.”. 《The Cochrane Database of Systematic Reviews》 1: CD007497. doi:10.1002/14651858.CD007497.pub2. PMID 25627012.
- ↑ “FDA Guideline for Industry: Geriatric Population” (PDF). 《FDA.gov》. 2016년 9월 14일에 원본 문서 (PDF)에서 보존된 문서.
