유전학의 역사

유전학의 역사(영어: history of genetics) 또는 유전학사(遺傳學史)는 히포크라테스, 아리스토텔레스 및 에피쿠로스에 의한 공헌과 함께 고전 시대부터 시작되었다. 인간은 경험적으로 선사시대부터 생물의 특징이 부모로부터 자식에게 유전되는 것을 이용한 품종개량을 해왔다. 과학적인 방법을 사용한 현대 유전학은 오스트리아의 아우구스티노 수도회 수사였던 그레고어 요한 멘델의 연구와 함께 시작되었다.[1] 유전학의 아버지라고도 불리는 멘델은 1866년에 완두의 교배 실험에 관한 논문 〈식물 교잡에 관한 실험〉(독일어: Versuche über Pflanzen-Hybriden, 영어: Experiments on Plant Hybridization)을 발표하였는데, 현재는 생명과학 교과서에 멘델의 유전법칙으로 정리되어 있다. 유전 현상에 대한 몇몇 이론들이 수세기 전부터, 멘델의 연구 이후에도 수십 년 간 제안되었는데, 멘델의 유전법칙 이전에는 혼합 유전과 같은 다양한 유전 이론이 통용되고 있었다.
멘델의 논문은 발표 당시에는 주목을 받지 못하였으나, 1900년에 휴고 드 브리스(네덜란드), 카를 코렌스(독일), 에리히 폰 체르마크(오스트리아)에 의한 "멘델의 재발견" 과정에서 유전학의 기본 이론으로 자리잡았다. 1903년에 월터 서턴이 "유전물질은 염색체 위에 존재하며, 염색체를 통해 자손에게 전달된다"는 염색체설을 주장한 이후에[2] 유전학계는 유전물질의 규명을 위해 노력하였다. 1915년까지 멘델 유전학의 기본 원리가 다양한 생물체, 특히 초파리(Drosophila melanogaster)에 적용되었다. 1925년에 토머스 헌트 모건과 그의 동료들은 널리 받아들여지게 된 멘델 모델을 더욱 발전시켰다. 모건은 "각각의 유전자는 염색체 위에 일정한 위치에 있으며, 대립유전자는 상동염색체의 동일한 위치에 존재한다"는 유전자설을 주장하였다.
실험적인 연구와 함께 수학자들은 집단유전학의 통계적 틀을 개발하여 유전학적 설명을 진화 연구에 도입하였다. 1928년에 프레더릭 그리피스는 폐렴균의 형질전환 실험을 하였고, 1944년에 오즈월드 에이버리는 그리피스의 실험을 훨씬 더 정교하게 설계하여 유전물질이 DNA라는 것을 증명하였지만, 단백질이 유전물질일 것이라는 당시 학계의 강한 믿음 때문에 이 실험 결과는 받아들여지지 않았다.[3] 1952년에 앨프리드 허시와 마사 체이스는 박테리오파지를 이용한 허시와 체이스의 실험을 통해 DNA가 유전물질이라는 것을 증명하였고, 학계에서도 이를 받아들였다.[4]
유전자를 물려받는 기본 패턴이 확립되면서, 많은 생물학자들은 유전자의 물리적 특성에 대한 연구를 시작했다. 1940년대와 1950년대 초의 실험들은 염색체의 한 부분인 DNA에 유전자가 있음을 알려주었다. 1953년에 제임스 D. 왓슨과 프랜시스 크릭이 DNA 이중 나선의 구조를 밝혀내고,[5] 1955년에 프레더릭 생어는 DNA와 아미노산의 관계를 규명하여 유전자 발현 기작을 밝혀내고 인슐린의 아미노산 배열을 규명하였다.[6] 바이러스와 세균과 같은 새로운 모델 실험체에 초점을 맞춘 실험들과 그 성과들은 유전학을 분자유전학의 시대로 이끌었다.
다음 몇 년 동안 화학자들은 핵산의 염기 서열 분석 기술과 단백질의 아미노산 서열 분석 기술을 개발했으며, 다른 연구자들은 핵산과 단백질의 관계, 유전 암호를 밝히기 위한 연구를 수행했다. 유전자 발현의 조절은 1960년대의 핵심 쟁점이었다. 1970년대에 유전공학을 통해 유전자 발현을 조절하고 조작할 수 있었다. 20세기의 마지막 십년 동안 많은 생물학자들은 전체 유전체(게놈)의 염기 서열을 밝히기 위해 대규모 유전학 프로젝트에 초점을 맞추었다. 2003년 인간 게놈 프로젝트가 완료되어 인간의 전체 게놈 지도가 완성되었다.[7]
멘델 이전의 유전에 대한 생각[편집]
고대의 유전이론[편집]
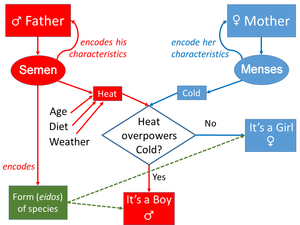
유전에 대한 가장 영향력이 있는 고대의 이론은 히포크라테스와 아리스토텔레스의 이론이었다. 히포크라테스의 이론(아마도 아낙사고라스의 가르침에 기초를 둔 것으로 추정)은 훗날 찰스 다윈이 제안한 범생설(pangenesis)과 비슷하였다. 히포크라테스는 신체를 형성하는 요소들이 모여 다음 세대에 유전된다고 보았다. 아리스토텔레스는 비물리적인 이데아론 대신에 생물의 형질이 정액(혈액의 정화된 형태로 생각함)과 임신 중인 산모의 생리혈을 통해 자손에게 전달되며, 정액과 생리혈이 생물의 초기 발생을 지시하기 위해 자궁 속에서 서로 상호작용한다고 보았다.[8] 히포크라테스와 아리스토텔레스 이래로 거의 모든 서구 학자들은 19세기 말까지 획득형질이 유전된다라고 생각했다. 동시에 개별 종은 고정된 본질을 가지고 있으며 유전되는 변화는 단순히 피상적인 것이라고 생각했다.[9] 아테네의 철학자 에피쿠로스는 가족들을 관찰하고 남성과 여성 둘 다 유전형질(에피쿠로스는 “sperm atom"이라고 부름)을 전달한다고 제안했고, 유전의 우성형질과 열성형질에 대해 주목하고 유전형질의 분리와 독립적인 구분을 주장했다.[10]
300년 경에 고대 인도의 의학 서적인 《차라카 삼히타》(Charaka Samhita)에서는 자손의 형질이 4가지 요인에 의해 결정된다고 보았는데, (1) 어머니의 생식물질, (2) 아버지의 정자, (3) 임신한 어머니가 섭취한 음식물 (4) 태아로 들어간 영혼이 그것이다. 이 4가지 요인 각각에는 4가지 부분이 있어 부모와 영혼의 업보가 어떤 속성이 지배적인지를 결정함으로써 자손에게 형질을 부여한 16가지 요인을 창안했다.[11]
9세기에 아프리카계 아랍인 작가 알 자히즈(Al-Jahiz)는 자연 환경이 동물의 생존 가능성에 미치는 영향을 고려했다.[12][13] 그는 자신의 저서 《동물의 서》에서 다음과 같이 기록하고 있다.
| “ | 동물들은 생존을 위해 경쟁한다. 자원을 얻고 포식자를 피하며 자손을 번식시키면서 경쟁하게 된다. 자연 환경은 생물이 생존을 위해 새로운 특징을 갖도록 영향을 준다. 그 결과 새로운 생물 종이 만들어진다. 이렇게 살아남은 동물은 자신의 새로운 특징을 자손에게 물려준다. | ” |
— 알 자히즈[14]
|
1000년에 아랍 의사인 아부 알 카심 알 자라위(Abu al-Qasim al-Zahrawi, 서구에서는 알부카시스(Albucasis)로 알려져 있음)는 자신의 의학 개론서인 《알 타스리프》(Al-Tasrif)에서 이베리아반도에 있던 일가의 병력 연구 결과를 근거로 혈우병의 유전적 본질을 분명히 기술한 최초의 의사였다.[15][16] 1140년에 유다 하레비(Judah HaLevi)는 《쿠자리》(Kuzari)라는 책에서 우성 유전형질과 열성 유전형질을 기술했다.[17]
식물계통분류학 및 잡종 형성[편집]
18세기에 식물과 동물의 다양성에 대한 지식이 증가하고, 그에 따라 분류학에 대한 관심이 높아지면서 유전에 관한 새로운 생각들이 등장하기 시작했다. 린네를 비롯한 요제프 고트리이프 쾰로이터(Joseph Gottlieb Kölreuter), 칼 프리드리히 폰 거르트너(Carl Friedrich von Gärtner), 샤를 빅토르 노댕(Charles Victor Naudin)과 같은 연구자들은 잡종 형성 특히 종간 잡종에 대한 광범위한 실험을 수행했다. 종간 잡종 연구자들은 잡종 불임 및 여교배(戾交配, backcrossing)의 높은 가변성을 포함하여 다양한 유전 현상을 기술했다.[18]
또한 식물 육종가들은 많은 중요한 식물 종에서 안정적인 변종을 개발하고 있었다. 19세기 초에 프랑스의 오퀴스탱 사주렛(Augustin Sageret)은 일부 식물 품종을 교배했을 때 부모 중 하나에 나타난 어떤 형질이 보통 자손에게도 나타남을 알아내고 우성의 개념을 확립했고, 또한 부모에게서 발견된 일부 조상 형질이 자손에서 나타날 수 있다는 것을 발견했다. 그러나 영국의 존 가턴(John Garton)에 의한 식물 육종에 대한 과학적 접근이 있었음에도 불구하고,[19] 식물 육종가들은 그들의 연구에 대한 이론적 기반을 확립하거나 생리학 연구에 그들의 지식을 공유하려고 시도하지 않았다.[20]
멘델[편집]

그레고어 멘델은 1856년과 1863년 사이의 교배 실험에서 완두의 특정 형질의 유전 패턴을 추적하여 어떤 형질이 우성이고, 어떤 형질이 열성인가라는 문제가 간단한 통계학적 규칙을 따른다는 것을 보여주었다. 이러한 멘델 유전의 패턴은 유전에 대한 통계 적용이 매우 유용할 수 있다는 것을 보여주었고, 또한 여러 세대 동안 교배되어도 형질이 분리되어 남아 있기 때문에 19세기의 혼합 유전을 반박하였다.[21]
멘델은 통계적 분석을 통해 자신이 형질이라고 기술한 개념을 정의했다. 자신의 역사적인 논문에서 멘델은 형질을 만드는 물질을 지정하기 위해 "유전인자"라는 용어를 사용했다.
| “ | 실험에 따르면 모든 경우에 있어서 부모의 난세포와 꽃가루가 같은 형질을 가지고 있을 때 부모와 동일한 형질의 자손이 생성된다는 것을 확인할 수 있었고, 순종끼리 정상적인 교배를 하였을 경우 같은 자손이 나오는 것을 볼 수 있었다. 그러므로 잡종 식물에서 일정한 형태가 만들어지는 과정에서도 유전인자가 작용한다고 볼 수 있다. | ” |
— 그레고어 멘델, 1866년
|
멘델은 완두의 교배 실험에 대한 연구 결과를 1865년 2월 8일과 1866년 3월 8일에 두 부분으로 나누어 발표한 후, 1866년에 브르노에 있는 자연사 학회에 〈식물 교잡에 관한 실험〉(독일어: Versuche über Pflanzen-Hybriden, 영어: Experiments on Plant Hybridization)이라는 제목의 논문을 출판했다.[22]
멘델 이후, 멘델의 재발견 이전까지[편집]
범생설[편집]

멘델의 연구는 상대적으로 잘 알려져 있지 않은 과학 학술지에 발표되었으며, 과학계의 관심을 받지 못했다. 멘델 시대의 생물학은 많은 부분이 미지의 영역으로 남아있었으며, 멘델 스스로도 자신의 완두에 대한 실험을 모든 생물 종에 일반화 시킬 수 있다고 생각하지 않았다.[23] 대신, 유전 방식에 대한 논쟁은 자연 선택에 의한 다윈의 진화론에 의해 이루어졌다. 다윈의 유전 이론인 범생설(pangenesis)은 그다지 널리 수용되지 못했다.[24][25] 다윈의 사촌인 프랜시스 골턴은 범생설을 보다 수학적으로 다듬어서 유전에 대한 생물측정학을 발전시켰다.[26] 비록 유전의 정확한 메커니즘이 밝혀지지 않은 상황이었지만, 골턴과 그의 후계자인 칼 피어슨이 이끈 생물측정학은 유전과 진화에 대한 통계적 모델을 구축하려고 시도했었다.
생식질 연속설[편집]
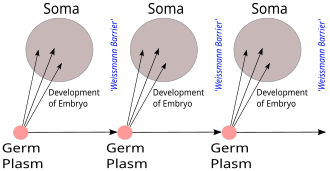
1883년에 독일의 아우구스트 바이스만은 외과적으로 꼬리를 제거한 쥐를 교배하는 실험을 수행했다. 그 결과 쥐의 꼬리를 외과적으로 제거한 것은 자손의 꼬리에 아무런 영향을 미치지 않았고, 범생설과 용불용설은 도전을 받게 되었다. 라마르크의 용불용설은 생물의 일생동안 일어난 변화 즉, 후천적으로 얻은 획득형질이 자손에게 유전될 수 있다고 설명했다. 바이스만은 유전 정보는 정자와 난자 같은 생식세포에 의해서만 다음 세대로 유전된다고 주장한 생식질 연속설(germ plasm theory)이라는 유전 이론을 제안했다.[27]
멘델의 재발견[편집]
휴고 드 브리스는 생식질의 성질이 무엇인지에 대해 궁금해했으며, 특히 생식질이 페인트처럼 섞이는지 아닌지 또는 정보가 파손되지 않는 분리된 패킷으로 운반되는지 여부에 대해 궁금해했다. 1890년대에 드 브리스는 다양한 식물 종을 대상으로 교배 실험을 수행했으며, 1897년에 유전된 형질이 부모로부터 하나씩 물려받는 두 개의 개별 정보 인자에 의해 결정되고, 이 입자들이 다음 세대로 전달된다는 논문을 발표했다. 1900년에 드 브리스가 논문을 준비하고 있을 때 드 브리스의 연구와 관련이 있다고 생각한 지인이 멘델의 1866년의 논문을 드 브리스에게 보여주었다. 처음에 드 브리스는 멘델의 논문에 대한 우선권을 언급하지 않고, 1900년에 자신의 논문을 발표했다. 같은 해에 다른 식물학자인 카를 코렌스는 옥수수와 완두의 교배 실험을 수행하고, 자신과 비슷한 결과를 얻은 멘델의 논문을 보고, 자신의 결과를 발표하기 전에 관련 실험에 대한 문헌을 조사하고 있었다. 코렌스는 멘델의 논문에 대한 우선권을 인정하지 않고 멘델의 논문을 도용한다고 드 브리스를 비난하였다. 같은 시기에 또 다른 식물학자인 에리히 폰 체르마크도 완두 교배 실험을 하여 멘델과 같은 결과를 얻었다. 체르마크도 관련 연구에 대한 문헌을 조사하던 중 멘델의 논문을 발견하였다. 드 브리스는 자신의 후속 논문에서 멘델의 공로를 언급하고, 자신은 멘델의 연구를 단지 확장했을 뿐임을 인정했다.[27]
분자유전학의 출현[편집]
멘델의 재발견 이후, 유전 메커니즘 문제에 대해 윌리엄 베이트슨과 칼 피어슨 간의 논쟁이 있었고, 로널드 피셔가 〈멘델 유전의 가정에 대한 친족 간의 상관관계〉(영어: The Correlation Between Relatives on the Supposition of Mendelian Inheritance)라는 논문에서 이 문제를 해결하였다.

1910년에 토머스 헌트 모건은 특정 염색체 상에 유전자가 존재함을 보여주었다. 나중에 모건은 유전자가 염색체의 특정 부위를 차지한다는 것을 보여주었다. 이러한 지식을 바탕으로 해서 모건과 그의 제자들은 초파리(Drosophila melanogaster)의 염색체 지도를 최초로 만들기 시작했다. 1928년에 프레더릭 그리피스는 유전자가 형질전환될 수 있음을 보여주었다. 그리피스의 실험으로 알려진 이 실험에서 죽은 병원성 세균에 있는 어떤 물질이 비병원성 세균 내로 들어가 비병원성 세균을 병원성 세균으로 형질전환시켰음을 알게 되었다. 형질전환을 일으킨 물질은 병원성 세균의 유전정보를 비병원성 세균으로 운반하였고, 그리피스는 이 물질이 유전물질이라고 생각하였다.
이 후 일련의 발견으로 유전물질은 DNA(디옥시리보핵산)로 이루어져 있다는 사실을 알게 되었다. 1941년에 조지 웰스 비들과 에드워드 로리 테이텀은 유전자 돌연변이가 대사 경로의 특정 단계에서 이상을 일으킨다는 것을 보여주었다. 이것은 특정 유전자가 특정 단백질을 암호화하는 1유전자 1효소설을 이끌어냈다.[28] 오즈월드 에이버리, 콜린 먼로 매클라우드(Colin Munro MacLeod, 맥클린 맥카티(Maclyn McCarty)는 1944년에 DNA가 유전정보를 가지고 있음을 보여주었다.[29] 1952년에 로절린드 프랭클린과 레이먼드 고슬링(Raymond Gosling)은 나선 형태를 시사하는 선명한 X선 회절 패턴을 만들었고, 1953년에 제임스 D. 왓슨과 프랜시스 크릭은 DNA의 분자 구조를 밝혀냈다. 이러한 발견들은 DNA의 유전정보가 RNA로 전사되고, 이 RNA의 정보를 토대로 단백질로 번역된다는 것을 나타내는 분자생물학의 중심 원리를 확립시켰다. 이 후에 중심 원리에는 레트로바이러스의 역전사와 같은 예외가 있는 것으로 밝혀졌다.
1972년에 벨기에 헨트 대학교의 발터 피어스(Walter Fiers)와 그의 동료들은 박테리오파지 MS2의 외피 단백질 유전자의 염기서열을 최초로 밝혀냈다.[30] 리처드 J. 로버츠와 필립 앨런 샤프는 1977년에 유전자가 단편으로 절단될 수 있음을 발견하였다. 이것은 하나의 유전자가 여러 단백질을 만들 수 있다는 발상을 이끌어냈다. 많은 생물 유전체의 성공적인 염기서열 분석은 유전자의 분자적 정의를 복잡하게 만든다. 특히 유전자는 분리된 구슬처럼 DNA 상에 나란히 위치하는 것처럼 보이지 않는다. 대신에 구별되는 단백질을 만드는 DNA의 영역이 겹칠 수 있으므로 "유전자는 하나의 긴 연속체"라는 의견이 출현했다.[31][32] 월터 길버트는 1986년에 RNA가 간단한 촉매와 유전정보 저장의 역할을 수행할 수 있다면 DNA나 단백질은 초기 지구의 원시 생명 시스템에서 요구되지 않는다고 최초로 가정했다.
DNA 수준에서 유전학에 대한 현대의 연구는 분자유전학으로 알려져 있으며, 전통적인 다윈의 진화론과 집단유전학의 통합은 현대 진화설(종합설)로 알려져 있다.
고전 유전학[편집]
- 1856년~1863년: 멘델은 완두의 교배 실험을 바탕으로 세대 간에 형질의 유전을 연구했다. 멘델은 부모로부터 자손에게 전달되는 특정한 실체가 있다고 추론했다. 멘델은 유전의 기본 법칙인 우열의 원리, 분리의 법칙, 독립의 법칙을 수립했다.
- 1866년: 오스트리아의 아우구스티노 수도회 수사 그레고어 멘델이 〈식물 교잡에 관한 실험〉(독일어: Versuche über Pflanzen-Hybriden, 영어: Experiments on Plant Hybridization)이란 논문을 발표했다.
- 1869년: 프리드리히 미셔가 백혈구의 핵에서 오늘날 DNA라고 부르는 약한 산성물질을 발견하였다. 1871년에 미셔는 붕대의 세포에서 세포핵을 분리한 다음, 단백질 분해효소인 펩신으로 처리했다. 미셔는 자신이 발견한 산성물질을 "뉴클레인(nuclein)"이라 불렀다.[33]
- 1880년~1890년: 발터 플레밍, 에두아르트 슈트라스부르거, 에두아르 반 베네당(Edouard Van Beneden)은 세포 분열 과정 동안 염색체의 분배 방식을 밝혀냈다.
- 1889년: 리하르트 알트만(Richard Altmann)은 단백질이 없는 DNA를 정제했다. 그러나 핵산은 그가 추정한 것만큼 순수한 물질이 아니었다. 나중에 핵산은 다량의 단백질을 포함하고 있는 것으로 밝혀졌다.
- 1889년: 휴고 드 브리스는 "생물에서 특정 형질의 유전은 입자에 의해 일어난다"라고 가정하고, 이 입자의 이름을 "(pan)genes"라고 하였다.[34]
- 1902년: 아치볼드 개로드(Archibald Garrod)는 선천적인 물질대사 이상을 발견했다. 비록 간접적이긴 하나 상위(epistasis)에 대한 설명은 개로드의 연구에서 중요하다. 개로드가 겐티스산의 존재로 인해 소변이 빠르게 검게 변하는 이상인 알캅톤뇨증을 연구했을 때 해당 병증을 나타내는 부모와 밀접한 관련이 있음을 알아냈다.[35][36][37]
- 1903년: 월터 서턴과 테오도어 보베리는 멘델 방식으로 분리되는 염색체가 유전 단위라는 염색체설을 독자적으로 가정했다.[38] 보베리는 성게의 모든 염색체가 배아 발달을 위해 존재해야 한다는 것을 발견했다. 서턴의 메뚜기에 대한 연구는 서로 상동인 모계 염색체와 부계 염색체의 쌍이 감수 분열시 분리됨을 보여주었다.[39] 서턴은 이것이 "멘델의 유전법칙의 물리적 기초"일 수 있다고 결론지었다.[40]
- 1905년: 윌리엄 베이트슨은 애덤 세지윅(Adam Sedgwick)에게 보낸 편지와[41] 1906년의 회의에서 "유전학(genetics)"이란 용어를 사용했다.[42]
- 1908년: 고드프리 해럴드 하디와 빌헬름 바인베르크(Wilhelm Weinberg)는 유전적 평형 상태에 있는 멘델 집단에서는 대를 거듭하여도 대립유전자의 빈도가 변하지 않고 일정하게 유지된다는 하디-바인베르크 평형 모델을 제안했다.
- 1910년: 토머스 헌트 모건은 초파리(Drosophila melanogaster)의 반성유전 형질의 특성을 연구하면서 유전자가 염색체 상에 존재함을 보여주었다. 모건은 흰 눈 초파리 돌연변이체가 멘델의 분리의 법칙과 독립의 법칙에 기초한 반성유전을 한다는 것을 밝혀냈다.[43]
- 1911년: 모건의 제자 중 한 명인 앨프리드 스터티번트는 재조합 빈도에 기초한 연관 지도 작성법을 개발했다.[44]
- 1913년: 앨프리드 스터티번트가 세계 최초로 염색체의 유전자 지도를 만들었다.[45] 유전자 지도는 선형 배열 유전자를 포함하는 염색체를 보여주었다.
- 1918년: 로널드 피셔가 〈멘델 유전의 가정에 대한 친족 간의 상관관계〉(영어: The Correlation Between Relatives on the Supposition of Mendelian Inheritance)라는 논문을 발표하여 집단유전학과 진화생물학을 통합한 현대 종합설이 시작되었다.(집단유전학 문서를 참고)
- 1920년: 리센코학설이 등장하였다. 리센코학설 지지자들은 유전인자가 세포핵 뿐만 아니라 세포질에도 있다고 주장했다.[46]
- 1923년: 프레더릭 그리피스는 세균의 형질전환을 연구하여 DNA가 병원성 유전자를 전달하는 것을 관찰했다.[47]

- 1928년: 프레더릭 그리피스는 죽은 세균의 유전물질이 살아있는 세균에 통합될 수 있음을 발견했다. (그리피스의 실험 문서를 참조)
- 1930년대~1950년대: 요아힘 헴메를링(Joachim Hämmerling)은 세포의 형태 형성과 발달에 핵과 세포질 물질(나중에 각각 DNA와 mRNA인 것으로 밝혀짐)의 기여를 구별하기 위해 삿갓말(삿갓말속, Acetabularia) 이식 실험을 수행했다.[48][49]
- 1931년: 교차는 재조합의 원인으로 확인되었는데, 교차에 대한 최초의 세포학적 증명은 바버라 매클린톡과 해리엇 크레이턴(Harriet Creighton)에 의해 수행되었다.
- 1933년: 장 브라쉐(Jean Brachet)는 성게 알을 연구하면서 DNA는 세포핵에서 발견되고, RNA는 세포질에만 존재한다고 제안했다. 염색체에서 DNA를 발견하고, RNA가 모든 세포의 세포질에 존재함을 입증하였다. 당시에는 “효모 핵산”(RNA)은 식물에서만, “흉선 핵산”(DNA)는 동물에서만 생성된다고 여겨졌다. DNA는 세포의 pH를 완충시키는 기능을 가진 사량체일 것이라고 여겨졌다.[50][51]
- 1933년: 토머스 헌트 모건은 연관 지도 작성에 대한 공로로 노벨 생리학·의학상을 수상했다. 모건의 연구로 유전에서 염색체가 수행하는 역할을 알게 되었다.
- 1941년: 에드워드 로리 테이텀과 조지 웰스 비들은 유전자가 단백질을 암호화한다는 것을 보여주었다.[52] (분자생물학의 중심원리 문서를 참조)
- 1943년: 루리아와 델브뤼크의 실험은 박테리오파지에 저항성을 부여하는 유전적 돌연변이가 선택에 의한 반응이 아니라 선택이 없을 때 일어난다는 것을 보여주었다.[53]
DNA의 시대[편집]
- 1944년: 에이버리와 매클라우드와 맥카티의 실험은 그리피스의 실험을 발전시켜 유전물질이 DNA임을 증명하였지만, 단백질이 유전물질일 것이라는 당시 학계의 강한 믿음 때문에 이 사실이 받아들여지지 않았다.[54]
- 1947년: 살바도르 루리아가 방사선을 조사한 파지의 재활성화를 발견하고,[55] 박테리오파지 및 사람을 포함한 다른 생물에서 DNA 복구 기작에 대한 수 많은 연구를 촉진시켰다.[56]
- 1948년: 바버라 매클린톡이 옥수수에서 전이인자(트랜스포존, transposon)을 발견했다.
- 1950년: 어윈 샤가프(Erwin Chargaff)는 질소 염기들의 염기쌍 형성 방법을 밝혀냈다. 샤가프와 그의 동료들은 여러 생물체의 DNA를 연구하여 샤가프의 법칙을 발견했다. 각 생물의 DNA에서 아데닌(A)와 티민(T)의 비율이 같고(A=T), 구아닌(G)과 사이토신(C)의 비율이 같다(G=C). 따라서 퓨린 계열의 염기(A+G)의 비율과 피리미딘 계열의 염기(T+C)의 비율이 같다(A+G=T+C=50%).[57][58]

- 1952년: 허시와 체이스의 실험은 단백질과 DNA로 구성된 박테리오파지의 유전 정보가 DNA에 저장되어 있음을 밝혀냈다. 유전물질은 DNA임이 증명되었고, 학계에서도 이를 받아들였다.[59]
- 1952년: 5월에 로절린드 프랭클린이 지도한 학생인 레이먼드 고슬링(Raymond Gosling)이 DNA X선 회절 사진을 찍었다.[60]
- 1953년: 제임스 D. 왓슨과 프랜시스 크릭이 DNA 구조가 이중 나선 구조임을 밝혀냈다.[61]
- 1955년: 알렉산더 R. 토드는 질소 염기의 화학적 조성을 밝혀냈다. 또한 토드는 ATP와 FAD를 성공적으로 합성했다. 토드는 뉴클레오타이드 및 뉴클레오타이드 조효소에 대한 과학적 지식에 기여한 공로로 1957년 노벨 화학상을 수상했다.[62]
- 1955년: 조 힌 티지오(Joe Hin Tjio)는 알베르트 레반(Albert Levan)의 연구실에서 연구하는 동안 사람의 염색체수가 46개임을 밝혀냈다. 티지오는 사람 배아의 폐 조직에 대한 연구를 수행하던 중 슬라이드 글라스 위에서 염색체를 분리하는 기존의 기술을 개선하려고 시도하는 과정에서 기존의 48개로 알려져 있던 사람의 염색체수가 46개임을 알게 되었다. 이는 세포유전학의 세계에 혁명을 일으켰다.[63]
- 1957년: 아서 콘버그와 세베로 오초아는 DNA가 복제되는 방법의 발견 이후 시험관에서 DNA를 합성했다. DNA 중합효소 I으로 생체 외에서 DNA 합성에 필요한 요구 조건들을 알게 되었다. 콘버그와 오초아는 1959년에 노벨 생리학·의학상을 수상했다.[64][65]
- 1957년/1958년: 로버트 W. 홀리, 마셜 니런버그, 하르 고빈드 코라나가 tRNA 분자의 뉴클레오타이드 서열을 제안했다. 프랜시스 크릭이 어떤 종류의 어댑터 분자의 필요성을 제안했었고, 곧이어 홀리, 니런버그, 코라나가 이를 확인하였다. 이는 mRNA의 염기 서열과 폴리펩타이드 서열 사이의 연관성을 설명하는데 도움을 주었다. 홀리, 니런버그, 코라나는 효모 세포로부터 tRNA를 정제하였고, 1968년 노벨 생리학·의학상을 수상하였다.[66]

- 1958년: 메셀슨과 스탈의 실험으로 DNA가 반보존적으로 복제된다는 것이 증명되었다.[67]
- 1960년: 프랑수아 자코브와 자크 모노는 작동유전자에 의해 발현이 조절되는 유전자군인 오페론을 발견하였다.[68][69]
- 1961년: 프랜시스 크릭과 시드니 브레너는 틀이동 돌연변이(frameshift mutation)를 발견했다. 실험에서 박테리오파지 T4 유전자(rIIB)의 프로플라빈 유도성 돌연변이를 분리하였다. 프로플라빈은 DNA 염기 사이에 삽입됨으로써 돌연변이를 유발시키며, 일반적으로 단일 염기쌍을 삽입하거나 결실시킨다. 돌연변이체는 정상적인 rIIB 단백질을 생성할 수 없다.[70] 이러한 돌연변이는 rIIB 유전자가 DNA의 3개의 연속적인 염기가 단백질의 각 아미노산을 지정한다는 것을 증명하기 위해 사용되었다. 따라서 유전 암호는 트리플렛 코드이며, DNA의 트리플렛 코드에서 전사된 mRNA 상의 3개의 염기로 이루어진 유전 암호인 코돈은 특정 아미노산을 지정한다.
- 1961년: 시드니 브레너, 프랑수아 자코브, 매튜 메셀슨이 mRNA의 기능을 확인하였다.[71]
- 1961년~1967년: 마셜 니런버그, 하르 고빈드 코라나, 시드니 브레너, 프랜시스 크릭을 포한 여러 과학자들의 노력으로 유전 암호가 해독되었다.[72]
- 1964년: 하워드 테민이 RNA 바이러스를 사용하여 RNA가 DNA로 역전사될 수 있음을 보여주었다.
- 1964년: 리센코학설이 폐기되었다.
- 1966년: 마셜 니런버그, 필립 레더(Philip Leder), 하르 고빈드 코라나가 RNA 동종중합체(homopolymer)와 이종중합체(heteropolymer)를 이용한 실험을 통해 유전 암호를 해독하였다. 이 실험을 통해 효모 세포에서 RNA 상의 특정 3개의 염기가 어떤 아미노산으로 번역되는지를 알아낼 수 있었다.
- 1969년: 매리-루 파듀(Mary-Lou Pardue)와 조셉 G. 갈(Joseph G. Gall)이 세포의 DNA와 방사성 원소로 표지된 DNA를 분자적으로 혼성화시켜 특정 DNA 부분의 세포 내 위치를 탐지하는 방법을 제시하였다.
- 1970년: 해밀턴 O. 스미스와 다니엘 네이선스가 세균인 인플루엔자균(Haemophilus influenzae)의 연구에서 제한효소를 발견하여, 과학자들이 DNA를 자르고 붙이는 것을 가능하게 하였다.[73]
- 1972년: 스탠퍼드 대학교의 스탠리 노먼 코헨(Stanley Norman Cohen)과 캘리포니아 대학교 샌프란시스코 캠퍼스(UCSF)의 허버트 보이어(Herbert Boyer)가 제한효소를 이용하여 유전자가 들어있는 DNA와 플라스미드를 자르고 DNA 리게이스로 DNA와 플라스미드의 점착성 말단을 붙여서 재조합 DNA를 만들었다.[74]
유전체학의 시대[편집]

- 1972년: 벨기에 헨트 대학교 분자생물학 연구소의 발터 피어스(Walter Fiers)와 그의 동료들은 박테리오파지 MS2의 외피 단백질 유전자의 염기서열을 최초로 밝혀냈다.[75]
- 1976년: 발터 피어스와 그의 동료들은 박테리오파지 MS2 RNA의 전체 염기서열을 밝혀냈다.[76]
- 1976년: 효모의 유전자가 대장균에서 최초로 발현되었다.[77]
- 1977년: 프레더릭 생어, 월터 길버트, 앨런 맥삼(Allan Maxam)이 독자적으로 연구하여 최초로 DNA 염기서열을 밝혀냈다. 생어의 연구실에서 박테리오파지 Φ-X174 유전체의 전체 염기서열을 밝혀냈다.[78][79][80]
- 1970년대 후반: 핵산의 비방사성 표지 방법이 개발되었다. 면역세포화학과 면역형광법을 이용한 리포터 분자 탐지 기술의 개선, 형광 현미경 관찰 및 이미지 분석 기술의 진보와 같은 보다 안전하고, 빠르고, 신뢰할 수 있는 기술들이 등장하였다.
- 1980년: 폴 버그, 월터 길버트, 프레더릭 생어가 DNA의 구조를 매핑하는 방법을 개발하였다. 1972년에 폴 버그의 스탠퍼드 대학교 연구실에서 재조합 DNA 분자를 생성하였다. 폴 버그는 작은 원형 DNA 분자에 람다 파지 유전자를 삽입한 재조합 DNA 분자를 만든 공로로 1980년에 노벨 화학상을 길버트, 생어와 공동으로 수상하였다.[81]
- 1980년: 스탠리 노먼 고헨과 허버트 보이어가 플라스미드를 복제하고 세균에 외래 유전자를 도입하여 발현시킴으로써 유전자 클로닝에 대한 미국 최초의 특허를 획득하였다. 코헨과 보이어는 사람의 생장 호르몬, 에리트로포이에틴, 인슐린과 같은 단백질을 복제할 수 있었다. 스탠퍼드 대학교는 유전자 클로닝 특허권 사용료로 약 3억 달러를 벌었다.[82]
- 1982년: 미국 식품의약국(FDA)은 제넨테크사(社)가 1978년에 재조합 DNA를 이용하여 최초로 유전공학적 방법으로 생산한 사람 인슐린의 시판을 승인했다.[83] 승인 후, 클로닝 공정을 통해 휴물린(humulin)이 대량 생산되었다(일라이 릴리 앤드 컴퍼니가 라이센스를 갖고 있음).
- 1983년: 캐리 멀리스는 DNA의 손쉬운 증폭을 가능하게 하는 중합효소 연쇄 반응(PCR)을 고안했다.[84]
- 1983년: 바버라 매클린톡이 전이인자(트랜스포존) 발견에 대한 공로로 노벨 생리학·의학상을 수상하였다. 매클린톡은 옥수수에서 트랜스포존 매개 돌연변이와 염색체 절단을 연구하고, 1948년에 전이인자에 대한 첫 번째 보고서를 발표하였다. 매클린톡은 트랜스포존이 옥수수에서 광범위하게 관찰됨을 발견하였으나, 동일한 현상이 세균과 노랑초파리에서 발견된 1960년대와 1970년대까지 그녀의 주장은 널리 주목 받지 못했다.[85]

- 1985년: 알렉 제프리스(Alec Jeffreys)가 DNA 지문분석법을 발표했다. 제프리스는 질병을 유발하는 유전자를 이해하기 위해 DNA 변이와 유전자군의 진화를 연구했다. 제프리스는 질병을 유발하는 유전자를 이해하기 위해 DNA 변이와 유전자군의 진화를 연구했다.[86] 화학적 탐침을 사용하여 여러 개의 반복 DNA 부분을 한 번에 분리하는 과정을 개발하기 위해, 제프리스는 DNA의 X선 필름을 촬영하여 반복 DNA 부분이 사람마다 크게 다르다는 것을 확인했다. DNA 지문분석 기술에서 뉴클레이스 또는 제한효소로 처리하여 DNA 샘플을 자른 다음, 전기영동으로 각 절편들을 분리하여 겔의 줄무늬 패턴으로 이를 확인하였다.[87]
- 1986년: 제레미 네이선스(Jeremy Nathans)는 데이비드 호그니스(David Hogness), 더글라스 볼라스(Douglas Vollrath), 로널드 W. 데이비스(Ronald W. Davis)와 함께 망막의 복잡성을 연구하여 색각 및 색맹에 대한 유전자를 발견했다.[88]
- 1987년: 이시노 요시즈미(Ishino Yoshizumi)가 나중에 크리스퍼(CRISPR)라고 불리는 DNA 서열의 일부를 우연히 발견하고 설명하였다.
- 1989년: 토머스 체크는 RNA가 화학 반응을 촉매할 수 있음을 발견하여,[89] 분자유전학에서 가장 중요한 돌파구 중 하나를 만들었다. 왜냐하면 잘 알려져 있지 않은 DNA 부분의 진정한 기능을 밝히는 실마리가 되었기 때문이다.
- 1989년: 프랜시스 콜린스(Francis Collins)와 추이 랍치(徐立之, Lap-Chee Tsui)가 CFTR 단백질을 암호화하는 인간 유전자를 염기서열 분석하였다. 이 유전자의 이상은 낭포성 섬유증을 유발한다.[90]
- 1992년: 미국과 영국의 과학자들은 낭포성 섬유증과 혈우병과 같은 유전적 이상에 대해 생체 외에서(양수 검사) 배아를 검사하는 기술을 공개했다.
- 1993년: 필립 앨런 샤프와 리처드 J. 로버츠가 DNA의 유전자가 인트론과 엑손으로 구성되어 있다는 것을 발견한 공로로 노벨 생리학·의학상을 수상하였다. 그들의 발견에 따르면 DNA의 전사 산물인 RNA 가닥의 모든 뉴클레오타이드가 번역 과정에서 사용되는 것은 아니다. RNA 가닥의 인트론은 스플라이싱 과정에서 먼저 떨어져 나가고, 스플라이싱 후에 남은 RNA 부분(엑손)만이 폴리펩타이드로 번역된다.[91]
- 1994년: 유방암 유전자가 최초로 발견되었다. BRCA1은 1990년에 UC 버클리 킹 연구소의 연구원에 의해 발견되었고, 1994년에 처음으로 복제되었다. 유방암 발현의 두 번째 주요 유전자인 BRCA2는 1994년 후반 마이클 스트래튼(Michael Stratton) 교수와 리처드 우스터(Richard Wooster) 박사에 의해 발견되었다.
- 1995년: 세균인 인플루엔자균(Haemophilus influenzae)은 유전체의 염기서열이 밝혀진 최초의 생물이다.[92]
- 1996년: 효모의 일종인 Saccharomyces cerevisiae는 유전체의 염기서열이 밝혀진 최초의 진핵생물이다.
- 1996년: 알렉산더 리치(Alexander Rich)는 과도 상태에 있는 DNA의 일종인 Z-DNA를 발견했다. 이 DNA는 경우에 따라 전사와 관련이 있다.[93] Z-DNA는 사이토신과 구아닌이 풍부한 DNA 영역에서 잘 형성된다.[94]
- 1997년: 스코틀랜드의 로슬린 연구소의 이언 월머트(Ian Wilmut)와 그의 동료들은 복제양 돌리의 복제에 성공했다.[95]
- 1998년: 다세포 진핵생물로는 최초로 예쁜꼬마선충(Caenorhabditis elegans)의 유전체 염기서열이 공개되었다.
- 2000년: 노랑초파리(Drosophila melanogaster)의 전체 유전체 서열이 완성되었다.
- 2001년: 인간 게놈 프로젝트(Human Genome Project)와 셀레라 제노믹스(Celera Genomics)사가 인간 유전체의 최초 초안을 동시에 공개하였다.
- 2001년: 프란시스코 모히카(Francisco Mojica)와 러드 얀센(Rudd Jansen)은 생물체 내에서 유전자를 특별히 바꾸는데 사용될 수 있는 세균 DNA 서열을 기술하기 위해 CRISPR(크리스퍼)라는 머리글자어를 제안했다.

- 2003년 (4월 14일): 인간 게놈의 99%가 99.99%의 정확도로 염기서열 분석이 되어 인간 게놈 프로젝트가 성공적으로 완료되었다.[96]
- 2004년: 머크 엔드 컴퍼니는 종양 억제 유전자를 불활성화시키고, 자궁경부암의 70%를 유발하는 HPV 16 및 18의 감염으로부터 여성을 보호하는 인간 유두종 바이러스(HPV) 백신을 발표하였다.
- 2007년: 마이클 워로베이(Michael Worobey)는 유전적 돌연변이를 분석하여 인간 면역결핍 바이러스(HIV)의 진화적 기원을 추적하였고, 1960년대 초에 미국에서 HIV 감염이 일어났었다는 것을 밝혀냈다.
- 2007년: 티모시 레이 브라운(Timothy Ray Brown)은 조혈줄기세포 이식을 통해 HIV/AIDS로부터 치료된 최초의 사람이 되었다.
- 2008년: 미국 휴스턴에 소재한 인트로젠(Introgen)사는 암과 리-프라우메니 증후군(Li-Fraumeni syndrome)에 대한 최초의 유전자 치료제인 애드벡신(Advexin, FDA 승인 대기 중)을 개발했다. 에드벡신은 p53 종양 억제유전자를 운반하기 위해 아데노바이러스를 벡터로 이용했다.
- 2010년 : 2세대 유전자가위인 탈렌(TALENs, transcription activator-like effector nucleases)이 DNA의 특정 서열을 자르는데 처음으로 사용되었다.
- 2016년: NASA의 우주비행사 캐슬린 루빈스(Kathleen Rubins)는 국제 우주 정거장에서 미니언(MinION) 장치를 사용하여 우주 공간에서 최초로 쥐, 대장균, 람다파지 바이러스의 게놈을 염기서열 분석했다.[97]
같이 보기[편집]
각주[편집]
- ↑ Weiling, F (1991). "Historical study: Johann Gregor Mendel 1822–1884.". American journal of medical genetics 40 (1): 1–25; discussion 26. doi:10.1002/ajmg.1320400103. PMID 1887835.
- ↑ 고인석, 과학의 지형도, 이화여자대학교출판부, 2007, ISBN 89-7300-738-6, 216-217쪽
- ↑ 위르겐 브라터, 안미라 역, 즐거운 생물학, 살림, 2009, ISBN 89-522-1086-7, 172-174쪽
- ↑ Hershey, AD; Chase (1952). "Independent functions of viral protein and nucleic acid in growth of bacteriophage.". The Journal of general physiology 36 (1): 39–56. doi:10.1085/jgp.36.1.39. PMID 12981234.
- ↑ Watson, J. D.; Crick (1953). "Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid". Nature 171: 737. doi:10.1038/171737a0.
- ↑ 존 시몬스, 여을환 역, 사이언티스트 100, 세종서적, 1997, ISBN 89-85509-69-1, 349-352쪽
- ↑ "Human Genome Project Information Archived 2008년 3월 15일 - 웨이백 머신". Human Genome Project. Retrieved 15 March 2008.
- ↑ 가 나 Leroi, Armand Marie (2010). Föllinger, S., 편집. 《Function and Constraint in Aristotle and Evolutionary Theory》. 《Was ist 'Leben'? Aristoteles' Anschauungen zur Entstehung und Funktionsweise von Leben》 (Franz Steiner Verlag). 215–221쪽.
- ↑ Mayr, The Growth of Biological Thought, pp 635-640
- ↑ Yapijakis C. (2017) Ancestral Concepts of Human Genetics and Molecular Medicine in Epicurean Philosophy. In: Petermann H., Harper P., Doetz S. (eds) History of Human Genetics. Springer, Cham
- ↑ Bhagwan, Bhagwan; Sharma, R.K. (2009년 1월 1일). 《Charaka Samhita》. Chowkhamba Sanskrit Series. sharirasthanam II.26–27쪽. ISBN 978-8170800125.
- ↑ Zirkle C (1941). “Natural Selection before the "Origin of Species"”. 《Proceedings of the American Philosophical Society》 84 (1): 71–123. JSTOR 984852.
- ↑ Mehmet Bayrakdar (Third Quarter, 1983). "Al-Jahiz And the Rise of Biological Evolutionism", The Islamic Quarterly. London. [1]
- ↑ Gary Dargan, Intelligent Design Archived 2010년 11월 7일 - 웨이백 머신, Encounter, Australian Broadcasting Corporation. 2010년 4월 10일 읽어봄.
- ↑ Cosman, Madeleine Pelner; Jones, Linda Gale. 《Handbook to life in the medieval world》. Infobase Publishing. 528–529쪽. ISBN 0-8160-4887-8.
- ↑ Patricia Skinner (2001), Unani-tibbi, Encyclopedia of Alternative Medicine
- ↑ HaLevi, Judah, translated and annotated by N. Daniel Korobkin. The Kuzari: In Defense of the Despised Faith, p. 38, I:95: "This phenomenon is common in genetics as well—often we find a son who does not resemble his father at all, but closely resembles his grandfather. Undoubtedly, the genetics and resemblance were dormant within the father even though they were not outwardly apparent. Hebrew by Judah Ibn Tibon, p.375: ונראה כזה בענין הטבעי, כי כמה יש מבני האדם שאינו דומה לאב כלל אך הוא דומה לאבי אביו ואין ספק כי הטבע ההוא והדמיון ההוא היה צפון באב ואף על פי שלא נראה להרגשה
- ↑ Mayr, The Growth of Biological Thought, pp 640-649
- ↑ For example, Explanatory Notes, Gartons Seed Catalogue for Spring 1901
- ↑ Mayr, The Growth of Biological Thought, pp 649-651
- ↑ Siddhartha Mukherjee|Mukherjee, Siddartha (2016) The Gene:An intimate history Chapter 4.
- ↑ 멘델의 논문(영문): Gregor Mendel (1865). "Experiments in Plant Hybridization"
- ↑ 존 그리번, 최주연 역, 과학의 역사 2, 에코 리브르, 2005, ISBN 89-90048-58-3, 153쪽
- ↑ Darwin, C. R. (1871). Pangenesis. Nature. A Weekly Illustrated Journal of Science 3 (27 April): 502-503.
- ↑ Geison, G. L. (1969). “Darwin and heredity: The evolution of his hypothesis of pangenesis”. 《J Hist Med Allied Sci》 XXIV (4): 375–411. doi:10.1093/jhmas/XXIV.4.375.
- ↑ Bulmer, M. G. (2003). 《Francis Galton: Pioneer of Heredity and Biometry》. Johns Hopkins University Press. 116–118쪽. ISBN 978-0-801-88140-4.
- ↑ 가 나 Siddhartha Mukherjee|Mukherjee, Siddartha (2016) The Gene:An intimate history Chapter 5.
- ↑ Gerstein MB, Bruce C, Rozowsky JS, Zheng D, Du J, Korbel JO, Emanuelsson O, Zhang ZD, Weissman S, Snyder M (June 2007). “What is a gene, post-ENCODE? History and updated definition”. 《Genome Research》 17 (6): 669–681. doi:10.1101/gr.6339607. PMID 17567988.
- ↑ Steinman RM, Moberg CL (February 1994). “A triple tribute to the experiment that transformed biology”. 《The Journal of Experimental Medicine》 179 (2): 379–84. doi:10.1084/jem.179.2.379. PMC 2191359. PMID 8294854.
- ↑ Min Jou W, Haegeman G, Ysebaert M, Fiers W (May 1972). “Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein”. 《Nature》 237 (5350): 82–8. Bibcode:1972Natur.237...82J. doi:10.1038/237082a0. PMID 4555447.
- ↑ Pearson, H. (May 2006). “Genetics: what is a gene?”. 《Nature》 441 (7092): 398–401. Bibcode:2006Natur.441..398P. doi:10.1038/441398a. PMID 16724031.
- ↑ Pennisi E (June 2007). “Genomics. DNA study forces rethink of what it means to be a gene”. 《Science》 316 (5831): 1556–1557. doi:10.1126/science.316.5831.1556. PMID 17569836.
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.210
- ↑ Vries, H. de (1889) Intracellular Pangenesis [2] ("pan-gene" definition on page 7 and 40 of this 1910 translation in English)
- ↑ Principles of Biochemistry / Nelson and Cox – 2005. pp.681
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.383-384
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008). pp. 430-431
- ↑ Ernest W. Crow & James F. Crow (2002년 1월 1일). “100 years ago: Walter Sutton and the chromosome theory of heredity”. 《Genetics》 160 (1): 1–4. PMC 1461948. PMID 11805039.
- ↑ O'Connor, C. & Miko, I. (2008) Developing the chromosome theory. Nature Education [3]
- ↑ Sutton, W. S. (1902). “On the morphology of the chromosome group in Brachystola magna” (PDF). 《Biological Bulletin》 4 (24–3): 39.
- ↑ Online copy of William Bateson's letter to Adam Sedgwick 보관됨 2007-10-13 - 웨이백 머신
- ↑ Bateson, William (1907). 〈The Progress of Genetic Research〉. Wilks, W. (editor). 《Report of the Third 1906 International Conference on Genetics: Hybridization (the cross-breeding of genera or species), the cross-breeding of varieties, and general plant breeding》. London: Royal Horticultural Society.
- Although the conference was titled "International Conference on Hybridisation and Plant Breeding", Wilks changed the title for publication as a result of Bateson's speech.
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. p.99
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.147
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.109
- ↑ Online summary of "Real Genetic vs. Lysenko Controversy
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.190
- ↑ Hämmerling, J. (1953). Nucleo-cytoplasmic relationships in the development of Acetabularia. Int. Rev. Cytol. 2, 475-498. link.
- ↑ Mandoli, D.F. (1998). What ever happened to Acetabularia? Bringing a once-classic model system into the age of molecular genetics. Int. Rev. Cytol. 182:1-67. link.
- ↑ Brachet, J. (1933). Recherches sur la synthese de l'acide thymonucleique pendant le developpement de l'oeuf d'Oursin. Archives de Biologie 44: 519-576.
- ↑ Burian, R. (1994). Jean Brachet's Cytochemical Embryology: Connections with the Renovation of Biology in France? In: Debru, C., Gayon, J. and Picard, J.-F. (eds.). Les sciences biologiques et médicales en France 1920-1950, vol. 2 of Cahiers pour I'histoire de la recherche. Paris: CNRS Editions, pp. 207-220. link.
- ↑ Beadle, GW; Tatum, EL (November 1941). “Genetic Control of Biochemical Reactions in Neurospora”. 《Proc. Natl. Acad. Sci. U.S.A.》 27: 499–506. Bibcode:1941PNAS...27..499B. doi:10.1073/pnas.27.11.499. PMC 1078370. PMID 16588492.
- ↑ Luria, SE; Delbrück, M (November 1943). “Mutations of Bacteria from Virus Sensitivity to Virus Resistance”. 《Genetics》 28: 491–511. PMC 1209226. PMID 17247100.
- ↑ Oswald T. Avery; Colin M. MacLeod & Maclyn McCarty (1944). “Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III”. 《Journal of Experimental Medicine》 79 (1): 137–58. doi:10.1084/jem.79.2.137. PMC 2135445. PMID 19871359.35th anniversary reprint available
- ↑ Luria, SE (1947). “Reactivation of Irradiated Bacteriophage by Transfer of Self-Reproducing Units”. 《Proc. Natl. Acad. Sci. U.S.A.》 33: 253–64. Bibcode:1947PNAS...33..253L. doi:10.1073/pnas.33.9.253. PMC 1079044. PMID 16588748.
- ↑ Bernstein, C (1981). “Deoxyribonucleic acid repair in bacteriophage”. 《Microbiol. Rev.》 45: 72–98. PMC 281499. PMID 6261109.
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. pp.217 Table 9.1
- ↑ Tamm, C.; Herman, T.; Shapiro, S.; Lipschitz, R.; Chargaff, E. (1953). “Distribution Density of Nucleotides within a Desoxyribonucleic Acid Chain”. 《Journal of Biological Chemistry》 203 (2): 673–688.
- ↑ Hershey, AD; Chase, M (May 1952). “Independent functions of viral protein and nucleic acid in growth of bacteriophage”. 《J. Gen. Physiol.》 36: 39–56. doi:10.1085/jgp.36.1.39. PMC 2147348. PMID 12981234.
- ↑ “Due credit”. 《Nature》 496: 270. 2013년 4월 18일. doi:10.1038/496270a.
- ↑ Watson JD, Crick FH (Apr 1953). “Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid”. 《Nature》 171 (4356): 737–8. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. PMID 13054692.
- ↑ Todd, AR (1954). “CHEMICAL STRUCTURE OF THE NUCLEIC ACIDS” (PDF). 《Proc. Natl. Acad. Sci. U.S.A.》 40: 748–55. Bibcode:1954PNAS...40..748T. doi:10.1073/pnas.40.8.748. PMC 534157. PMID 16589553.
- ↑ Wright, Pearce (2001년 12월 11일). “Joe Hin Tjio The man who cracked the chromosome count”. The Guardian.
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008) pp. 548
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. (Discovery of DNA polymerase I in E. Coli) pp.255
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008) pp. 467-469
- ↑ Meselson, M; Stahl, FW (July 1958). “THE REPLICATION OF DNA IN ESCHERICHIA COLI”. 《Proc. Natl. Acad. Sci. U.S.A.》 44: 671–82. Bibcode:1958PNAS...44..671M. doi:10.1073/pnas.44.7.671. PMC 528642. PMID 16590258.
- ↑ Jacob, F; Perrin, D; Sánchez, C; Monod, J; Edelstein, S (June 2005). “[The operon: a group of genes with expression coordinated by an operator. C.R.Acad. Sci. Paris 250 (1960) 1727-1729]”. 《Comptes Rendus Biologies》 328: 514–20. doi:10.1016/j.crvi.2005.04.005. PMID 15999435.
- ↑ Jacob, F; Perrin, D; Sanchez, C; Monod, J (February 1960). “[Operon: a group of genes with the expression coordinated by an operator]”. 《C. R. Acad. Sci.》 250: 1727–9. PMID 14406329.
- ↑ Crick, FH; Barnett, L; Brenner, S; Watts-Tobin, RJ (1961). “General nature of the genetic code for proteins”. 《Nature》 192: 1227–32. Bibcode:1961Natur.192.1227C. doi:10.1038/1921227a0. PMID 13882203.
- ↑ “Molecular Station: Structure of protein coding mRNA (2007)”. 2012년 4월 3일에 원본 문서에서 보존된 문서. 2019년 1월 27일에 확인함.
- ↑ Crick, FH; Barnett, L; Brenner, S; Watts-Tobin, RJ (December 1961). “General nature of the genetic code for proteins”. 《Nature》 192: 1227–32. Bibcode:1961Natur.192.1227C. doi:10.1038/1921227a0. PMID 13882203.
- ↑ Principles of Genetics / D. Peter Snustad, Michael J. Simmons – 5th Ed. (Discovery of DNA polymerase I in E. Coli) pp.420
- ↑ Genetics and Genomics Timeline: The discovery of messenger RNA (mRNA) by Sydney Brenner, Francis Crick, Francois Jacob and Jacques Monod [4]
- ↑ Min Jou W, Haegeman G, Ysebaert M, Fiers W (May 1972). “Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein”. 《Nature》 237 (5350): 82–8. Bibcode:1972Natur.237...82J. doi:10.1038/237082a0. PMID 4555447.
- ↑ Fiers W, Contreras R, Duerinck F, Haegeman G, Iserentant D, Merregaert J, Min Jou W, Molemans F, 외. (1976). “Complete nucleotide-sequence of bacteriophage MS2-RNA - primary and secondary structure of replicase gene”. 《Nature》 260 (5551): 500–507. Bibcode:1976Natur.260..500F. doi:10.1038/260500a0. PMID 1264203.
- ↑ Genetics, The hisB463 Mutation and Expression of a Eukaryotic Protein in Escherichia coli Vol. 180, 709-714, October 2008 [5]
- ↑ Sanger F, Air GM, Barrell BG, Brown NL, Coulson AR, Fiddes CA, Hutchison CA, Slocombe PM, Smith M, 외. (Feb 1977). “Nucleotide sequence of bacteriophage phi X174 DNA”. 《Nature》 265 (5596): 687–95. Bibcode:1977Natur.265..687S. doi:10.1038/265687a0. PMID 870828.
- ↑ Sanger, F; Nicklen, S; Coulson, AR (December 1977). “DNA sequencing with chain-terminating inhibitors” (PDF). 《Proc. Natl. Acad. Sci. U.S.A.》 74: 5463–7. Bibcode:1977PNAS...74.5463S. doi:10.1073/pnas.74.12.5463. PMC 431765. PMID 271968.
- ↑ Principles of Biochemistry / Nelson and Cox – 2005. pp.296-298
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008). pp. 976 - 977
- ↑ Patents 4 Life: Bertram Rowland 1930–2010. Biotech Patent Pioneer Dies (2010) [6]
- ↑ Funding Universe: Genentech, Inc
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008). Pp. 763
- ↑ The Significance of Responses of the Genome to Challenge / Barbara McClintock – Science New Series, Vol. 226, No. 4676 (1984), pp. 792-801
- ↑ Lemelson MIT Program—Inventor of the week: Alec Jeffreys – DNA FINGERPRINTING (2005) [7]
- ↑ Jeffreys, AJ; Wilson, V; Thein, SL (1985). “Individual-specific ‘fingerprints’ of human DNA”. 《Nature》 316: 76–79. Bibcode:1985Natur.316...76J. doi:10.1038/316076a0. PMID 2989708.
- ↑ Wikidoc: Color Blindness – Inheritance pattern of Color Blindness (2010) [8]
- ↑ Cell and Molecular Biology, Concepts and experiments / Gerald Karp –5th Ed (2008) pp. 478
- ↑ Kerem B; Rommens JM; Buchanan JA; Markiewicz; Cox; Chakravarti; Buchwald; Tsui (September 1989). “Identification of the cystic fibrosis gene: genetic analysis”. 《Science》 245 (4922): 1073–80. Bibcode:1989Sci...245.1073K. doi:10.1126/science.2570460. PMID 2570460.
- ↑ A Century of Nobel Prize Recipients / Francis Leroy - 2003. pp 345
- ↑ Fleischmann RD; Adams MD; White O; Clayton; Kirkness; Kerlavage; Bult; Tomb; Dougherty; Merrick; McKenney; Sutton; Fitzhugh; Fields; Gocyne; Scott; Shirley; Liu; Glodek; Kelley; Weidman; Phillips; Spriggs; Hedblom; Cotton; Utterback; Hanna; Nguyen; Saudek; 외. (July 1995). “Whole-genome random sequencing and assembly of Haemophilus influenzae Rd”. 《Science》 269 (5223): 496–512. Bibcode:1995Sci...269..496F. doi:10.1126/science.7542800. PMID 7542800.
- ↑ Rich, A; Zhang, S (July 2003). “Timeline: Z-DNA: the long road to biological function” (PDF). 《Nature Reviews Genetics》 4: 566–572. doi:10.1038/nrg1115. PMID 12838348.
- ↑ “The Discovery of Z-DNA: the Work of Alexander Rich”. 《The Journal of Biological Chemistry》 284 (51): e23–e25. PMC 2791029.
- ↑ CNN Interactive: A sheep cloning how-to, more or less(1997) http://www.cnn.com/TECH/9702/24/cloning.explainer/index.html
- ↑ National Human Genome Research Institute / The Human Genome Project Completion: FAQs (2010) [9]
- ↑ “DNA sequenced in space for first time”. BBC News. 2016년 8월 30일. 2016년 8월 31일에 확인함.
더 읽을거리[편집]
- Elof Axel Carlson, Mendel's Legacy: The Origin of Classical Genetics (Cold Spring Harbor Laboratory Press, 2004.) ISBN 0-87969-675-3
외부 링크[편집]
- Olby's "Mendel, Mendelism, and Genetics," at MendelWeb
- ""Experiments in Plant Hybridization" (1866), by Johann Gregor Mendel," by A. Andrei at the Embryo Project Encyclopedia
- http://www.accessexcellence.org/AE/AEPC/WWC/1994/geneticstln.html
- https://web.archive.org/web/20110716181415/http://www.sysbioeng.com/index/cta94-11s.jpg
- http://www.esp.org/books/sturt/history/
- http://cogweb.ucla.edu/ep/DNA_history.html
- http://news.bbc.co.uk/1/hi/in_depth/sci_tech/2000/human_genome/749026.stm
- https://web.archive.org/web/20120323085256/http://www.hchs.hunter.cuny.edu/wiki/index.php?title=Modern_Science&printable=yes
- http://jem.rupress.org/content/79/2/137.full.pdf
- http://www.nature.com/physics/looking-back/crick/Crick_Watson.pdf
- Todd, AR (1954). “CHEMICAL STRUCTURE OF THE NUCLEIC ACIDS” (PDF). 《Proc. Natl. Acad. Sci. U.S.A.》 40: 748–55. Bibcode:1954PNAS...40..748T. doi:10.1073/pnas.40.8.748. PMC 534157. PMID 16589553.
- http://www.genomenewsnetwork.org/resources/timeline/1960_mRNA.php
- https://web.archive.org/web/20120403041525/http://www.molecularstation.com/molecular-biology-images/data/503/MRNA-structure.png
- http://www.genomenewsnetwork.org/resources/timeline/1973_Boyer.php
- http://www.genetics.org/cgi/content/full/180/2/709
- Sanger, F; Nicklen, S; Coulson, AR (December 1977). “DNA sequencing with chain-terminating inhibitors” (PDF). 《Proc. Natl. Acad. Sci. U.S.A.》 74: 5463–7. Bibcode:1977PNAS...74.5463S. doi:10.1073/pnas.74.12.5463. PMC 431765. PMID 271968.
- Jeffreys, AJ; Wilson, V; Thein, SL (1985). “Individual-specific ‘fingerprints’ of human DNA”. 《Nature》 316: 76–79. Bibcode:1985Natur.316...76J. doi:10.1038/316076a0. PMID 2989708.
- “Biological Catalysis by RNA”. 《Annual Review of Biochemistry》 55: 599–629. doi:10.1146/annurev.bi.55.070186.003123.
- http://www.cnn.com/TECH/9702/24/cloning.explainer/index.html
- http://www.genome.gov/11006943
