헤모글로빈
| 헤모글로빈 | |
|---|---|
 사람 헤모글로빈의 구조. α 글로빈 소단위체는 빨간색, β 글로빈 소단위체는 파란색, 철을 함유한 헴기는 녹색으로 표시되어 있다. 출처: PDB 1GZX Proteopedia Hemoglobin | |
| 식별자 | |
| 상징 | Hb, Hgb |
| 다른 정보 | |
| 유전자 자리 | Chr. 16 [1] |
헤모글로빈(미국 영어: hemoglobin, 영국 영어: haemoglobin,[주 1] Hb 또는 Hgb)은 철을 함유하고 있는 단백질로 적혈구에서 산소 운반을 촉진한다. 혈색소(血色素)라고도 한다. 남극빙어과에 속하는 어류를 제외하고,[3] 거의 모든 척추동물은 헤모글로빈을 가지고 있다.[4] 혈액 속의 헤모글로빈은 호흡 기관(폐 또는 아가미)로부터 신체의 다른 조직으로 산소를 운반하며, 조직 세포에서 산소를 방출하여 동물의 물질대사에서 에너지를 생성하는 산소 호흡을 가능하게 한다. 건강한 사람은 혈액 100 mL 당 12~20 g의 헤모글로빈을 가지고 있다. 헤모글로빈은 금속단백질, 색소단백질, 글로불린이다.
포유류에서 헤모글로빈은 적혈구 건조 중량(물 제외)의 약 96%를 차지하고, 전체 중량(물 포함)의 약 35%를 차지한다.[5] 헤모글로빈은 그램(g)당 1.34 mL의 O2와의 산소 결합 능력을 갖고 있으며,[6] 이는 혈장의 용존 산소량에 비해 혈액의 총 산소 용량을 70배 증가시킨다.[7] 포유류의 헤모글로빈 분자는 최대 4개의 산소 분자와 결합하여 운반할 수 있다.[8]
헤모글로빈은 또 다른 기체들도 운반한다. 이는 신체에서 세포 호흡으로 생성된 이산화 탄소 중 일부(전체의 약 20~25%)[9]를 카바미노헤모글로빈으로 운반하게 하며, 여기서 CO2는 헴단백질에 결합한다. 이 분자는 또한 글로빈 단백질의 싸이올기에 결합된 중요한 조절 분자인 산화 질소를 운반하며 산소와 동시에 방출한다.[10]
헤모글로빈은 또한 흑색질의 A9 도파민작동성 뉴런, 대식세포, 폐포 세포, 폐, 망막 색소 상피, 간세포, 콩팥의 혈관사이 세포, 자궁내막 세포, 자궁경부 세포, 질 상피 세포를 포함한 다른 세포에서도 발견된다.[11] 이러한 조직에서 헤모글로빈은 항산화제로서 불필요한 산소를 흡수하고 철 대사를 조절한다.[12] 혈액 내 포도당이 과도하면 포도당이 헤모글로빈에 달라붙어 헤모글로빈 A1c의 수치가 높아질 수 있다.[13]
헤모글로빈과 헤모글로빈 유사 분자는 많은 무척추동물, 균류, 식물에서도 발견된다.[14] 이들 생물에서 헤모글로빈은 산소를 운반하거나 이산화 탄소, 산화 질소, 황화 수소, 황화물과 같은 다른 저분자와 이온을 운반하고 조절할 수 있다. 레그헤모글로빈이라는 변종은 콩과식물의 질소 고정 뿌리혹과 같은 혐기성 환경에서 산소를 제거하여 산소 중독을 방지하는 역할을 한다.
빈혈의 한 형태로 의학적 상태인 헤모글로빈혈증은 혈관 내 용혈로 인해 발생하며, 여기서 헤모글로빈은 적혈구에서 혈장으로 누출된다.
연구 역사[편집]

1825년에 요한 프리드리히 엥겔하르트(Johann Friedrich Engelhart)는 여러 생물종의 헤모글로빈에서 철과 단백질의 비율이 동일하다는 것을 발견했다.[16][17] 그는 알려진 철의 원자량으로부터 헤모글로빈의 분자량을 n × 16000 (n = 헤모글로빈 분자당 철 원자의 수, 현재 4로 알려져 있음)으로 계산했는데, 이는 단백질의 분자량을 최초로 결정한 것이다. 이러한 "성급한 결론"은 어떤 분자도 그렇게 클 수 있다는 것을 믿을 수 없었던 동료 연구자들로부터 조롱거리가 되었다. 그러나 길버트 스미슨 아데어는 1925년에 헤모글로빈 용액의 삼투압을 측정하여 엥겔하르트의 결과를 확인하였다.[18]
혈액은 적어도 1794년부터 산소를 운반하는 것으로 알려져 있었지만,[19][20] 헤모글로빈의 산소 운반 특성은 1840년에 휘네펠트(Hünefeld)에 의해 설명되었다.[21] 1851년에 독일의 생리학자인 오토 푼케는 적혈구를 순수한 물, 알코올, 에터와 같은 용매로 연속적으로 희석한 후 생성된 단백질 용액에서 용매를 천천히 증발시켜 헤모글로빈 결정을 성장시키는 방법을 설명한 일련의 논문들을 발표했다.[22][23] 헤모글로빈의 가역적 산소화는 몇년 후 펠릭스 호페자일러에 의해 설명되었다.[24]
X선 결정학의 발달로 단백질의 구조를 분석하는 것이 가능해졌다.[25] 1959년에 맥스 퍼루츠는 헤모글로빈의 분자 구조를 결정했다.[26][27] 이러한 연구로 퍼루츠는 구상 단백질인 미오글로빈의 서열을 밝혀낸 존 켄드루와 함께 1962년에 노벨 화학상을 공동으로 수상했다.[25][28]
혈액 내에서 헤모글로빈의 역할은 프랑스의 생리학자인 클로드 베르나르에 의해 밝혀졌다. 헤모글로빈(hemoglobin)이라는 이름은 헴(heme)과 글로빈(globin)이라는 단어로부터 유래되었으며, 이는 헤모글로빈의 각 소단위체가 헴기를 가지고 있는 구상 단백질이라는 사실을 반영한다. 각 헴기에는 이온 유도 쌍극자 힘을 통해 1개의 산소 분자와 결합할 수 있는 1개의 철 원자가 포함되어 있다. 포유류에서 가장 흔한 유형의 헤모글로빈에는 이러한 소단위체 4개가 포함되어 있다.
유전학[편집]
헤모글로빈은 단백질의 과학적 특성과 기능을 결정하는 특정 아미노산의 긴 접힌 사슬인 폴리펩타이드로 이루어진 단백질 소단위체(글로빈 분자)로 구성된다. 모든 폴리펩타이드의 아미노산 서열은 해당 유전자의 DNA의 한 부분에서 번역된다. 단백질의 화학적 특성과 기능을 결정하는 것은 아미노산의 서열이다.
하나 이상의 헤모글로빈 유전자가 존재한다. 사람의 경우 헤모글로빈 A(성인의 주요 헤모글로빈 형태)는 HBA1, HBA2, HBB 유전자에 의해 암호화된다.[29] 알파 1 및 알파 2 소단위체는 16번 염색체의 서로 가까운 HBA1과 HBA2 유전자에 의해 각각 암호화되어 있는 반면, 베타 소단위체는 11번 염색체의 11번 염색체의 HBB 유전자에 의해 암호화되어 있다. 글로빈 소단위체의 아미노산 서열은 일반적으로 종마다 다르며, 진화적 거리에 따라 그 차이가 커진다. 예를 들어, 사람, 보노보, 침팬지의 가장 일반적인 헤모글로빈 서열은 완전히 동일하며 정확히 동일한 α 및 β 글로빈 단백질 사슬을 가지고 있다.[30][31][32] 사람과 고릴라의 헤모글로빈은 α 사슬과 β 사슬 모두에서 1개의 아미노산이 다르며, 이러한 차이는 종 사이의 진화적 유연 관계가 멀어질수록 더 커진다.
헤모글로빈 유전자의 돌연변이는 단일 종 내에서 헤모글로빈 변이체를 초래할 수 있지만, 일반적으로 각 종에서 하나의 서열이 "가장 일반적"이다.[33][34] 이러한 돌연변이 중 다수는 질병을 유발하지 않지만, 일부는 헤모글로빈병증이라는 유전 질환을 유발한다. 가장 잘 알려진 헤모글로빈병증은 낫 모양 적혈구 빈혈증으로, 이느 분자 수준에서 메커니즘이 이해된 최초의 질병이었다. 지중해빈혈이라고 불리는 대부분 별개의 질병은 글로빈 유전자 발현의 조절 문제와 돌연변이를 통해 정상 헤모글로빈의 생산 부족, 때로는 비정상 헤모글로빈과 관련이 있다. 이 모든 질병은 빈혈을 유발한다.[35]

다른 단백질과 마찬가지로 헤모글로빈 서열의 변화도 적응적일 수 있다. 예를 들어, 헤모글로빈은 해수면의 높은 압력에 비해 산소 분압이 낮을수록 헤모글로빈과의 결합이 감소하는 높은 고도에서의 희박한 공기에 다양한 방식으로 적응하는 것으로 밝혀졌다. 사슴쥐에 대한 최근의 연구에서는 고지대와 저지대의 개체군 차이를 설명할 수 있는 4가지 유전자의 돌연변이가 발견되었다. 두 종의 유전자는 헤모글로빈의 산소 운반 능력을 조절하는 유전자를 제외하고는 사실상 동일하다는 사실이 밝혀졌다. 유전적 차이로 인해 고지대에 서식하는 쥐는 산소를 보다 효율적으로 사용할 수 있다.[36] 매머드의 헤모글로빈은 낮은 온도에서 산소 전달을 가능하게 하는 돌연변이를 특징으로 하여 매머드가 홍적세 동안 더 높은 위도로 이동할 수 있게 했다.[37] 이는 안데스 산맥에 서식하는 벌새에서도 발견되었다. 벌새는 이미 많은 에너지를 소비하므로 산소 요구량이 높지만 안데스 벌새는 높은 고도에서 번성하는 것으로 밝혀졌다. 높은 고도에서 서식하는 여러 종(Oreotrochilus, A. castelnaudii, C. violifer, P. gigas, A. viridicuada)의 헤모글로빈 유전자에 있는 비동의적 돌연변이()로 인해 이 단백질은 사람의 2,3-비스포스포글리세르산(2,3-BPG)와 유사한 역할을 하는 조류에서 발견되는 분자인 이노시톨 육인산에 대한 낮은 친화력을 가지고 있다. 이는 더 낮은 분압에서 산소와 결합하는 능력을 갖게 한다.[38]
또한 조류의 독특한 폐는 O2의 낮은 분압에서 산소의 효율적인 사용을 촉진한다. 이러한 두 가지 적응은 서로를 강화하고 조류가 높은 고도에서 기능을 수행하는 것을 설명한다.
헤모글로빈의 적응 사례는 사람에게도 적용할 수 있다. 해발 4,000 m에 거주하는 티베트 여성들 중 높은 산소 포화 유전자형을 가지고 있는 티베트 여성의 자손 생존율이 높다.[39] 자연선택은 이 유전자에 대한 주요 동력으로 보인다. 왜냐하면 자손의 사망률은 헤모글로빈-산소 친화력이 낮은 여성이 낳은 자손의 사망률과 비교할 때 헤모글로빈-산소 친화력이 더 높은 여성이 낳은 자손의 경우 상당히 낮기 때문이다. 이것이 일어나는 정확한 유전자형과 메커니즘은 아직 명확하지 않지만, 자연선택은 이러한 여성의 낮은 분압의 산소와 결합하는 능력에 작용하여 전체적으로 중요한 대사 과정을 더 잘 유지할 수 있게 한다.
합성[편집]
헤모글로빈은 복잡한 일련의 단계들을 거쳐 합성된다. 헴 부분은 미토콘드리아 및 미성숙 적혈구의 세포질에서 일련의 단계들을 거쳐 합성되며, 글로빈 단백질 부분은 세포질의 리보솜에 의해 합성된다.[40] 헤모글로빈의 생성은 전적아세포에서 골수의 망상적혈구에 이르기까지 초기 발생의 전반에 걸쳐 세포에서 계속된다. 이 시점에서 핵은 포유류의 적혈구에서 손실되지만, 조류와 다른 많은 종에서는 그렇지 않다. 포유류에서 핵이 소실된 후에도 잔류 리보솜 RNA(rRNA)는 망상적혈구가 순환계에 들어간 직후 RNA를 잃을 때까지 헤모글로빈을 추가적으로 합성하도록 한다. 실제로 이 헤모글로빈 합성 RNA는 망상적혈구에 망상 모양과 이름을 부여했다.[41]
헴의 구조[편집]

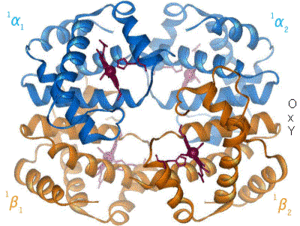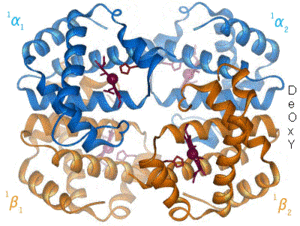
헤모글로빈은 많은 다중 소단위체 구형 단백질의 특징인 4차 구조를 가지고 있다.[42] 헤모글로빈에 있는 대부분의 아미노산은 α-나선을 형성하며, 이 나선은 짧은 비나선형 부분으로 연결된다. 수소 결합은 이 단백질 내부의 나선형 부분을 안정화시켜 분자 내 인력을 유발하고, 이로 인해 각 폴리펩타이드 사슬이 특정 모양으로 접히게 된다.[43] 헤모글로빈의 4차 구조는 대략 4면체 배열로 된 4개의 소단위체로 구성된다.[42]
대부분의 척추동물에서 헤모글로빈 분자는 4개의 구형 단백질 소단위체의 집합체이다. 각 소단위체는 비단백질 부분인 헴 보결분자단과 밀접하게 연관된 단백질 사슬로 구성된다. 각 단백질 사슬은 글로빈 접힘 배열로 서로 연결된 일련의 α-나선 구조 부분으로 배열된다. 이러한 배열은 미오글로빈과 같은 다른 헴/글로빈 단백질에 사용되는 것과 동일한 접힘 모티프이기 때문에 이러한 이름이 붙여졌다.[44][45] 이러한 접힘 패턴에는 헴기를 강력하게 묶는 포켓이 포함되어 있다.
헴기는 포르피린으로 알려진 헤테로고리에 결합된 철(Fe) 이온으로 구성된다. 이 포르피린 고리는 중앙에 철 이온이 결합되어 주기적으로 서로 연결된(메틴 브릿지에 의해) 4개의 피롤 분자로 구성된다.[46] 산소 결합 부위인 철 이온은 고리의 중앙에 있는 4개의 질소 원자와 배위 결합을 하며, 모두 한 평면에 놓여 있다. 헴은 포르피린 고리 아래 F8 히스티딘 잔기(근위 히스티딘으로도 알려짐)의 이미다졸 고리의 질소(N) 원자를 통해 구상 단백질에 강력하게(공유 결합으로) 결합된다. 여섯 번째 위치는 배위 결합을 통해 산소와 가역적으로 결합하여[47] 6개의 리간드로 구성된 팔면체 그룹을 완성할 수 있다. 이러한 산소와의 가역적 결합은 헤모글로빈이 조직 세포로 산소를 운반하는 데 상당한 도움을 준다.[48] 산소는 하나의 산소 원자가 Fe에 결합하고 다른 산소 원자가 비스듬히 돌출하는 "끝이 구부러진" 기하학적 형태로 결합한다. 산소가 결합되지 않으면 매우 약하게 결합된 물 분자가 그 자리를 채워 뒤틀린 팔면체를 형성한다.
이산화 탄소는 헤모글로빈에 의해 운반되지만 철 결합 위치에서 산소와 경쟁하지 않고 헴기에 부착된 단백질 사슬의 아미노기에 결합한다.
철 이온은 제일철(Fe2+) 또는 제이철(Fe3+) 상태일 수 있지만 페리헤모글로빈(메트헤모글로빈) (Fe3+)은 산소와 결합할 수 없다.[49] 결합 시 산소는 일시적 및 가역적으로 Fe2+에서 Fe3+로 산화되고, 산소는 일시적으로 초과산화물 이온으로 변하므로, 산소와 결합하려면 철이 산화수가 +2인 상태로 존재해야 한다. Fe3+과 관련된 초과산화물 이온이 양성자화되면 헤모글로빈 철은 산화된 상태로 유지되어 산소와 결합할 수 없다. 그러한 경우 메트헤모글로빈 환원효소는 철 중심을 환원시켜 결국 메트헤모글로빈을 재활성화할 수 있다.
성인에서 가장 일반적인 헤모글로빈 유형은 헤모글로빈 A라고 불리는 사량체(4개의 단백질 소단위체로 구성)이며, 비공유 결합으로 결합된 2개의 α 소단위체(141개의 아미노산 잔기로 구성) 및 2개의 β 소단위체(146개의 아미노산 잔기로 구성)로 구성된다. 헤모글로빈 A는 α2β2로 표시된다. α 소단위체와 β 소단위체는 구조적으로 유사하며 크기도 거의 같다. 각 소단위체는 약 16,000 달톤의 분자량을 가지며,[50] 사량체의 총 분자량은 약 64,000 달톤(64,458 g/mol)이다.[51] 1 g/dL = 0.1551 mmol/L이다. 헤모글로빈 A는 헤모글로빈 분자 중에서 가장 집중적으로 연구되었다.
유아의 경우, 태아 헤모글로빈 분자는 2개의 α 소단위체와 2개의 γ 소단위체로 구성된다. γ 소단위체는 유아가 성장함에 따라 점차적으로 β 사슬로 대체된다.[52]
4개의 폴리펩타이드 사슬은 염다리, 수소 결합 및 소수성 효과에 의해 서로 결합되어 있다.
산소 포화도[편집]
일반적으로 헤모글로빈은 산소 분자에 의해 포화되거나(옥시헤모글로빈) 불포화(디옥시헴글로빈)될 수 있다.[53]
옥시헤모글로빈[편집]
옥시헤모글로빈(산소헤모글로빈)은 생리적 호흡 중에 산소가 적혈구의 헤모글로빈 단백질의 헴 성분과 결합할 때 형성된다. 이 과정은 폐의 폐포에 인접한 폐 모세혈관에서 일어난다. 그런 다음 산소는 혈류를 통해 이동하여 세포에서 산화적 인산화 과정을 통해 ATP 생성을 위한 최종 전자 수용체로 활용된다. 그러나 혈액의 pH 감소를 막는 데는 도움이 되지 않는다. 환기 또는 호흡은 이산화 탄소를 제거하여 이러한 상태를 반전시켜 pH를 상승시킬 수 있다.[54]
헤모글로빈은 긴장된(taut 또는 tense, T) 형태와 이완된(relaxed, R) 형태의 두 가지 형태로 존재한다. 조직 수준에서 낮은 pH, 높은 CO2 및 높은 2,3-BPG와 같은 다양한 요인들은 산소 친화력이 낮고, 조직에서 산소를 방출하는 긴장된(T) 형태를 선호한다. 반대로, 높은 pH, 낮은 CO2 또는 낮은 2,3-BPG는 산소와 더 잘 결합할 수 있는 이완된(R) 형태를 선호한다.[55] 시스템의 분압도 O2 친화력에 영향을 미치며, 높은 산소 분압(예: 폐포에 존재하는 산소 분압)에서는 이완된(높은 친화력, R) 상태가 선호된다. 반대로 낮은 산소 분압(예: 좆기 세포에 존재하는 산소 분압)에서는 긴장된(낮은 친화력, T) 상태가 선호된다.[56] 또한 철(II) 헴에 산소가 결합하면 철이 포르피린 고리 평면으로 끌어당겨져 약간의 입체구조적 변화가 일어난다. 이러한 변화는 산소가 헤모글로빈 내에 남아 있는 3개의 헴 단위에 결합하도록 촉진한다(따라서 산소가 결합하는 것은 협동적이다).
고전적으로 옥시헤모글로빈의 철은 철(II) 산화 상태로 존재하는 것으로 보인다. 그러나 산소와 헴 철의 복합체는 반자성인 반면, 산소와 고스핀(high-spin) 철(II)은 둘 다 상자성이다. 실험적 증거는 헴 철이 옥시헤모글로빈에서 철(III) 산화 상태에 있고, 산소는 초과산화물 음이온(O2•−)으로 존재하거나 공유 결합 전하 전달 복합체에 있음을 강력히 시사한다.[57]
디옥시헤모글로빈[편집]
디옥시헤모글로빈(탈산소화된 헤모글로빈)은 결합된 산소가 없는 헤모글로빈의 형태이다. 옥시헤모글로빈과 디옥시헤모글로빈의 흡수 스펙트럼은 다르다. 옥시헤모글로빈은 디옥시헤모글로빈보다 660 nm 파장에서 훨씬 낮은 흡수율을 갖는 반면, 940 nm에서는 흡수율이 약간 더 높다. 이러한 차이는 맥박산소측정기라는 장비를 사용하여 환자 혈액의 산소량을 측정하는 데 사용된다. 이러한 차이는 또한 저산소증 동안 조직에서 일어나는 파란색에서 자줏빛을 띠는 청색증의 발현을 설명한다.[58]
디옥시헤모글로빈은 상자성이다. 디옥시헤모글로빈은 자기장에 약하게 끌린다.[59][60] 대조적으로 옥시헤모글로빈은 자기장으로부터 약한 반발력을 가지는 반자성을 나타낸다.[60]
척추동물에서 헤모글로빈의 진화[편집]
과학자들은 칠성장어가 턱이 있는 척추동물과 갈라진 후에 헤모글로빈에서 미오글로빈이 분리되는 사건이 일어났다는 데 동의한다.[61] 미오글로빈과 헤모글로빈의 이러한 분리는 이 두 분자가 서로 다른 기능을 가지며 진화하도록 허용했다. 미오글로빈은 산소의 저장과 더 많은 관련이 있는 반면, 헤모글로빈은 산소의 운반과 관련이 있다.[62] α-유사 글로빈 유전자 및 β-유사 글로빈 유전자는 단백질의 개별 소단위체를 암호화한다.[29] 이러한 유잔자의 전신은 약 4억 5천만년~5억년 전에 턱이 없는 물고기로부터 유래된 구절(gnathosome) 공통 조상 이후 또 다른 복제 사건을 통해 나타났다.[61] 조상 재구성 연구에 따르면 α 및 β 유전자의 중복 전 조상은 동일한 글로빈 소단위체로 구성된 이량체였으며, 이는 복제 후 사량체 구조로 조립되도록 진화했다.[63] α 및 β 유전자의 발달은 헤모글로빈이 산소를 운반하는 능력의 물리적 구성의 핵심인 여러 개의 서로 다른 소단위체로 구성될 가능성을 만들었다. 여러 소단위체를 갖는 것은 헤모글로빈이 협동적으로 산소와 결합하고 알로스테릭하게 조절되는 능력에 기여한다.[62][63] 그 후, α 유전자도 중복되는 사건을 거쳐 HBA1 및 HBA2 유전자를 형성했다.[64] 이러한 추가적인 중복과 발산으로 인해 다양한 발생 단계에서 특정 형태가 발생하도록 조절되는 다양한 범위의 α-유사 글로빈 유전자 및 β-유사 글로빈 유전자가 생성되었다.[62]
남극빙어과의 대부분의 뱅어는 찬물에 대한 적응으로 인해 헤모글로빈 유전자를 상실했다.[3]
협동성[편집]
산소가 철 복합체에 결합하면 철 원자가 포르피린 고리 평면의 중심을 향해 다시 이동하게 된다(오른쪽의 움직이는 그림 참조). 동시에 철의 다른 극에서 상호작용하는 히스티딘 잔기의 이미다졸 곁사슬이 포르피린 고리 쪽으로 당겨진다. 이러한 상호작용은 고리 평면을 사량체 바깥쪽으로 측면에 밀어넣고, 철 원자에 가까워질수록 히스티딘을 포함하는 단백질 나선에 변형을 유도한다. 이러한 변형은 사량체의 나머지 3개의 단량체로 전달되어 다른 헴 부위에서 유사한 입체구조적 변화를 유도하여 산소가 이들 부위에 더 쉽게 결합되도록 한다.
산소가 헤모글로빈의 한 단량체에 결합함에 따라 사량체의 입체구조는 T(긴장된) 상태에서 R(이완된) 상태로 변화한다. 이러한 변화는 나머지 3개의 단량체의 헴기에 대한 산소의 결합을 촉진하여 헤모글로빈 분자를 산소로 포화시킨다.[65]
따라서 정상적인 성인 헤모글로빈의 사량체 형태에서 산소의 결합은 협동적 과정이다. 산소에 대한 헤모글로빈의 결합 친화력은 분자의 산소 포화도에 의해 증가하며, 결합된 첫 번째 산소 분자는 결합에 유리한 방식으로 다음 분자의 결합 부위의 형태에 영향을 미친다. 이러한 긍정적인 협동적 결합은 위에서 논의된 바와 같이 헤모글로빈 단백질 복합체의 입체구조적 변화를 통해 달성된다. 즉, 헤모글로빈의 어떤 소단위체가 산소와 결합하면 전체 복합체의 입체구조적 변화가 시작되어 다른 소단위체의 산소에 대한 친화력이 증가한다. 결과적으로 헤모글로빈의 산소 결합 곡선은 비협동적 결합과 관련된 정상적인 쌍곡선 모양과 달리 S자형이 된다.
헤모글로빈의 협동성의 동적 메커니즘과 저주파 공명과의 관계가 논의되었다.[66]
산소 이외의 리간드의 결합[편집]
협동적인 방식으로 헤모글로빈에 결합하는 산소 리간드 외에도 헤모글로빈 리간드에는 일산화 탄소(CO)와 같은 경쟁적 저해제와 이산화 탄소(CO2) 및 산화 질소(NO)와 같은 알로스테릭 리간드도 포함된다. 이산화 탄소는 글로빈 단백질의 아미노기에 결합하여 카바미노헤모글로빈을 형성한다. 이러한 메커니즘은 포유류의 이산화 탄소 수송의 약 10%를 차지하는 것으로 생각된다. 산화 질소는 헤모글로빈을 통해서도 운반될 수 있다. 이는 글로빈 단백질의 특정 싸이올기와 결합하여 S-나이트로소싸이올을 형성하며, 헤모글로빈이 헴 부위로부터 산소를 방출함에 따라 유리 산화 질소와 싸이올로 다시 해리된다. 말초 조직으로의 산화 질소의 운반은 산소 수준이 낮은 조직에 혈관을 확장시키는 산화 질소를 방출함으로써 조직에서 산소 운반을 돕는 것으로 가정된다.[67]
경쟁적 저해제[편집]
산소의 결합은 일산화 탄소(예: 담배 흡연, 배기 가스, 용광로에서의 불완전 연소에 포함)와 같은 분자에 의해 영향을 받는다. 일산화 탄소(CO)는 헴 결합 부위에서 산소와 경쟁한다. 일산화 탄소(CO)에 대한 헤모글로빈의 결합 친화력은 산소(O2)에 대한 헤모글로빈의 결합 친화력보다 250배 정도 더 크다.[68][69] 이는 소량의 일산화 탄소가 표적 세포로 산소를 운반하는 헤모글로빈의 능력을 극적으로 감소시킨다는 것을 의미한다.[70] 일산화 탄소는 무색, 무취, 무미의 가스이고, 잠재적으로 치명적인 위협을 가하기 때문에 일산화 탄소 감지기는 주거지의 위험 수준을 경고하기 위한 용도로 상업적으로 이용된다. 헤모글로빈이 일산화 탄소와 결합하면 카복시헤모글로빈이라는 매우 밝은 빨간색 화합물을 형성하는 데, 이로 인해 일산화 탄소 중독 피해자가 사망 시 피부가 흰색이나 파란색이 아닌 분홍색을 나타낼 수 있다. 공기 흡입 시 일산화 탄소의 수준이 0.02% 이하로 낮으면 두통과 메스꺼움이 일어난다. 일산화 탄소의 농도가 0.1%로 증가하면 의식을 잃게 된다. 흡연을 많이 하는 사람의 경우 산소 활성 부위의 최대 20%가 일산화 탄소에 의해 차단될 수 있다.
유사한 방식으로, 헤모글로빈은 황화 수소(H2S)를 포함하여 사이안화물(CN−), 일산화 황(SO)및 황화물(S2−)에 대해서도 경쟁적인 결합 친화력을 가지고 있다. 이들 모두는 산화 상태를 바꾸지 않고 헴의 철분과 결합하지만 그럼에도 불구하고 산소의 결합을 억제하여 심각한 독성을 유발한다.
헴기의 철 원자는 처음에 제일철(Fe2+) 산화 상태에 있어야 산소 및 다른 기체 분자와 결합해서 운반할 수 있다. 위에서 설명한 것처럼 산소가 결합하는 동안 일시적으로 제이철(Fe3+) 상태로 전환된다. 산소가 없는 제이철(Fe3+) 상태로의 초기 산화는 헤모글로빈을 산소와 결합할 수 없는 헤미글로빈(hemiglobin) 또는 메트헤모글로빈으로 전환시킨다. 정상적인 적혈구의 헤모글로빈은 이러한 일이 발생하지 않도록 환원 시스템에 의해 보호된다. 산화 질소는 적혈구에서 헤모글로빈의 작은 부분을 메트헤모글로빈으로 전환시킬 수 있다. 후자의 반응은 글로빈의 보다 오래된 산화 질소 이산소화효소의 기능의 남은 활성이다.
알로스테릭 리간드[편집]
이산화 탄소는 헤모글로빈의 다른 결합 부위를 차지한다. 이산화 탄소가 높은 조직에서는 이산화 탄소가 헤모글로빈의 알로스테릭 부위에 결합하여 헤모글로빈으로부터 산소의 방출을 촉진하고 궁극적으로 산소가 대사 중인 조직으로 방출되게 한 다음 이산화 탄소는 체내로부터 제거된다. 정맥혈에서 이산화 탄소에 대한 이러한 증가된 친화력은 보어 효과로 알려져 있다. 탄산무수화효소를 통해 이산화 탄소는 다음과 같이 물과 반응하여 탄산을 생성하고, 탄산은 중탄산염과 양성자로 나누어진다.
- CO2 + H2O → H2CO3 → HCO3− + H+

따라서 이산화 탄소의 수치가 높은 혈액의 pH는 더 낮다(더 산성임). 헤모글로빈은 양성자 및 이산화 탄소와 결합할 수 있으며, 이는 단백질의 입체구조적 변화를 일으키고 산소의 방출을 촉진한다. 양성자는 단백질의 여러 부위에 결합하는 반면, 이산화 탄소는 α-아미노기에 결합한다.[71] 이산화 탄소는 헤모글로빈과 결합하여 카바미노헤모글로빈을 형성한다.[72] 이산화 탄소와 산의 결합으로 인해 헤모글로빈의 산소 친화력이 감소하는 현상을 보어 효과라고 한다. 보어 효과는 R 상태보다는 T 상태를 선호한다. 산소 포화도 곡선을 오른쪽으로 이동시킨다. 반대로 혈액 내 이산화 탄소 수치가 감소하면(즉, 폐 모세혈관에서) 이산화 탄소와 양성자가 헤모글로빈에서 방출되어 단백질의 산소 친화력이 증가한다. pH 감소로 인해 헤모글로빈의 산소에 대한 전체적인 결합 능력이 감소하는 것(즉, 산소 포화도 곡선이 오른쪽이 아니라 아래쪽으로 이동하는 것)을 루트 효과라고 한다. 이것은 뼈가 있는 물고기에서 볼 수 있다.
헤모글로빈은 헤모글로빈에 결합한 산소를 방출하는 것이 필요하다. 그렇지 않다면 결합하는 것에 대한 의미가 없다. 헤모글로빈의 S자형 곡선은 결합(폐에서 산소와 결합)과 해리(조직 세포에서 산소와 해리)에 효율적이다.[73]
높은 고도에 적응된 사람들의 경우 혈액 내 2,3-비스포스포글리세르산(2,3-BPG)의 농도가 증가하여 산소 분압이 낮은 조건에서 더 많은 양의 산소를 조직으로 전달할 수 있게 한다. 분자 Y가 분자 X의 수송 분자 Z에 대한 결합에 영향을 미치는 이러한 현상을 이종성 알로스테릭 효과(heterotropic allosteric effect)라고 한다. 높은 고도에서 생물체의 헤모글로빈도 2,3-BPG에 대한 친화력이 덜 하도록 적응하여 단백질이 R 상태로 더 많이 이동하게 된다. R 상태에서 헤모글로빈은 산소와 더 쉽게 결합하기 때문에 산소 분압이 낮을 때 생물체가 필요한 대사 과정을 수행할 수 있게 한다.[74]
사람 이외의 동물들은 헤모글로빈에 결합할 수 있는 서로 다른 분자들을 사용하여 불리한 조건에서 헤모글로빈의 산소(O2) 친화력을 변경한다. 물고기는 ATP와 GTP를 둘 다 사용한다. 이들은 물고기 헤모글리빈 분자의 인산염 "주머니(pocket)"에 결합하여 긴장 상태를 안정화시켜 산소 친화력을 감소시킨다.[75] GTP는 ATP보다 헤모글로빈의 산소 친화력을 훨씬 더 감소시키는 데, 이는 긴장 상태를 더욱 안정화시키는 추가적인 수소 결합이 형성되었기 때문인 것으로 생각된다.[76] 저산소 상태에서는 어류 적혈구에서 ATP와 GTP의 농도가 감소하여 산소 친화력이 증가한다.[77]
태아 헤모글로빈(HbF, α2γ2)이라고 불리는 헤모글로빈 변이체는 발생 중인 태아에서 발견되며 성인 헤모글로빈보다 더 큰 친화력으로 산소와 결합한다. 이는 태아 헤모글로빈의 산소 결합 곡선이 성인 헤모글로빈의 산소 결합 곡선과 비교하여 왼쪽으로 이동한다는 것을 의미한다. 즉, 더 높은 비율의 헤모글로빈이 더 낮은 산소 분압에서 산소와 결합되어 있다. 결과적으로 태반에 있는 태아의 혈액은 산소의 혈액으로부터 산소를 얻을 수 있다.
헤모글로빈은 또한 분자의 글로빈 부분으로 산화 질소(NO)를 운반한다. 이는 말초의 산소 운반을 개선하고 호흡의 조절에 기여한다. 산화 질소는 글로빈의 특정 시스테인 잔기에 가역적으로 결합한다. 결합은 헤모글로빈의 상태(R 또는 T)에 따라 달라진다. 생성된 S-나이트로실화 헤모글로빈은 혈관 저항, 혈압 및 호흡의 조절과 같은 다양한 산화 질소 관련 활성에 영향을 미친다. 산화 질소는 적혈구의 세포질에서 방출되지 않지만 음이온 교환체 1(AE1)이라는 음이온 교환체에 의해 적혈구 밖으로 운반된다.[78]
사람의 헤모글로빈 유형[편집]
헤모글로빈 변이체는 정상적인 배아 및 태아 발생의 일부분이다. 이는 또한 유전적 변이로 인해 개체군 내 헤모글로빈의 병리학적 돌연변이형일 수도 있다. 낫 모양 적혈구 빈혈증과 같은 일부 잘 알려진 헤모글로빈 변이체는 질병의 원인이 되며 헤모글로빈병증으로 간주된다. 다른 변이체는 탐지 가능한 병리를 일으키지 않기 때문에 비병리학적 변이체로 간주된다.[33][79]
배아에서의 변이체는 다음과 같다.
태아에서의 변이체는 다음과 같다.
신생아(출생 직후의 신생아)에서의 변이체는 다음과 같다.
- 헤모글로빈 A (성인 헤모글로빈) (α2β2) (PDB 1BZ0) – 가장 흔한 형태이며 정상적인 양은 95% 이상이다.
- 헤모글로빈 A2 (α2δ2) – δ 사슬의 합성은 임신 3분기 후반에 시작되며 성인의 경우 정상 범위는 1.5~3.5%이다.
- 헤모글로빈 F (태아 헤모글로빈) (α2γ2) – 성인의 경우 헤모글로빈 F는 F 세포라고 불리는 제한된 적혈구 집단으로 제한된다. 그러나 낫 모양 적혈구 빈혈증 및 배타-지중해빈혈이 있는 사람에서는 헤모글로빈 F의 수치가 높아질 수 있다.

질병에서 발생하는 비정상적인 형태는 다음과 같다.
- 헤모글로빈 D – (α2βD2) – 헤모글로빈의 변이체
- 헤모글로빈 H (β4) – β 사슬의 사량체로 형성된 헤모글로빈의 변이체로 α-지중해빈혈의 변이체에 존재할 수 있다.
- 헤모글로빈 바트 (γ4) – γ 사슬의 사량체로 형성된 헤모글로빈의 변이체로 α-지중해빈혈의 변이체에 존재할 수 있다.
- 헤모글로빈 S (α2βS2) – 낫 모양 적혈구 빈혈증 환자에서 발견되는 헤모글로빈의 변이체이다. β-사슬 유전자에 변이체로 인해 헤모글로빈의 특성이 변하여 적혈구가 병들게 된다.
- 헤모글로빈 C (α2βC2) – β-사슬 유전자의 변이로 인한 또 다른 변이체. 이 변이체는 경미한 만성 용혈성 빈혈을 유발한다.
- 헤모글로빈 E (α2βE2) – β-사슬 유전자의 변이로 인한 또 다른 변이체. 이 변이체는 경미한 만성 용혈성 빈혈을 유발한다.
- 헤모글로빈 AS – 하나의 성인 헤모글로빈 유전자와 하나의 낫 모양 적혈구 빈혈증 유전자를 가지고 있는 낫 모양 적혈구 형질을 일으키는 이형접합성 형태
- 헤모글로빈 SC 질환 – 하나의 낫 모양 적혈구 빈혈증 유전자와 헤모글로빈 C 유전자를 가지고 있는 이형접합성 형태
- 헤모글로빈 홉킨스-2 – 헤모글로빈 S와 결합하여 낫 모양 적혈구 빈혈증을 일으키는 것으로 여겨지는 헤모글로빈의 변이체이다.
척추동물에서 헤모글로빈의 분해[편집]
적혈구가 노화나 결함으로 인해 수명이 다하면 지라나 간에 있는 대식세포의 식세포 작용에 의해 순환계에서 제거되거나 순환계 내에서 용혈된다. 그런 다음 유리 헤모글로빈은 단핵구 또는 대식세포에서만 발현되는 헤모글로빈 수용체 CD163을 통해 순환계에서 제거된다. 이들 세포 내에서 헤모글로빈 분자는 분해되고 철분은 재활용된다. 이 과정은 또한 분해된 헴 분자 하나 당 일산화 탄소 한 분자를 생성한다.[80] 헴 분해는 인체 내 유일한 일산화 탄소의 천연적인 공급원이며, 정상적인 공기를 호흡하는 사람에서 혈액 내 일산화 탄소 수치를 정상으로 유지하는 역할을 한다.[81]
헴 분해의 또 다른 주요 최종 산물은 빌리루빈이다. 적혈구가 평소보다 더 빨리 파괴되면 혈액에서 빌리루빈의 수치가 증가되는 것으로 감지된다. 부적절하게 분해된 헤모글로빈 단백질이나 혈액 세포로부터 너무 빨리 방출된 헤모글로빈은 작은 혈관, 특히 콩팥의 여과 기능을 담당하는 섬세한 혈관을 막아 콩팥 손상을 일으킬 수 있다. 철은 헴으로부터 제거되어 나중에 사용하기 위해 회수되며, 조직에 헤모시데린이나 페리틴으로 저장되고 트랜스페린인 β-글로불린에 의해 혈장으로 운반된다. 포르피린 고리가 분해되면 파편은 일반적으로 빌리루빈이라는 노란색 색소로 분비되며, 이는 쓸개즙의 형태로 장으로 분비된다. 장은 빌리루빈을 유로빌리노젠으로 대사한다. 유로빌리노젠은 스테르코빌린이라는 색소 형태로 대변을 통해 몸 밖으로 배출된다. 글로불린은 아미노산으로 대사된 후 순환계로 방출된다.
헤모글로빈과 관련된 질병[편집]
헤모글로빈의 결핍은 빈혈에서와 같이 헤모글로빈 분자의 양이 감소하거나 동일한 산소 분압에서 산소와 결합하는 각 분자의 능력 감소로 인해 일어날 수 있다. 헤모글로빈병증(헤모글로빈 분자의 비정상적인 구조를 초래하는 유전적 결함)[82]은 두 가지 모두를 유발할 수 있다. 어쨌든 헤모글로빈의 결핍은 혈액의 산소 운반 능력을 감소시킨다. 헤모글로빈의 결핍은 일반적으로 혈액 내 산소 분압의 감소로 정의되는 저산소증과 엄격하게 구별된다.[83][84][85][86]
헤모글로빈 결핍의 다른 일반적인 원인으로는 혈액 손실, 영양 결핍, 골수 문제, 화학 요법, 신부전 또는 비정상적인 헤모글로빈(예: 낫 모양 적혈구 빈혈증) 등이 있다.
산소를 운반하는 각 헤모글로빈 분자의 능력은 일반적으로 변화된 혈액의 pH 또는 CO2 농도에 의해 변경되어 산소-헤모글로빈 해리 곡선의 변화를 유발한다. 그러나 일산화 탄소 중독과 같이 병리학적으로 변화될 수도 있다.
적혈구 수의 절대적인 감소 여부에 관계없이 헤모글로빈의 감소는 빈혈 증상을 유발한다. 빈혈의 원인은 다양하지만 철분 결핍증과 그에 따른 철분 결핍성 빈혈이 서구 세계에서 가장 흔한 원인이다. 철분이 없으면 헴의 합성이 감소하기 때문에 철분 결핍성 빈혈에서의 적혈구는 저색소성(적색 헤모글로빈 색소 부족) 및 소적혈구성(정상보다 크기가 작음)이다. 기타 빈혈들은 더 드물다. 용혈(적혈구 분해의 가속화)에서 관련된 황달은 헤모글로빈의 대사 산물인 빌리루빈에 의해 유발되며 순환하는 헤모글로빈은 신부전을 일으킬 수 있다.
글로빈 사슬의 일부 돌연변이는 낫 모양 적혈구 빈혈증 및 지중해빈혈과 같은 헤모글로빈병증과 관련이 있다. 문서의 시작 부분에서 논의한 것처럼 다른 돌연변이는 양성이며 단순히 헤모글로빈 변이체라고 한다.
헴 합성 대사 경로에 이상이 있는 것을 특징으로 하는 포르피린증으로 알려진 유전 질환의 부류가 있다. 영국의 조지 3세는 아마도 가장 유명한 포르피린증 환자이다.
헤모글로빈 A는 각 β 사슬의 말단의 발린(α-아미노산)에서 포도당과 어느 정도 천천히 결합한다. 생성된 분자는 당화 헤모글로빈인 Hb A1c라고도 한다. 헤모글로빈의 아미노산과 포도당의 결합은 많은 단백질에서 자발적으로(효소의 도움 없이) 일어나며 유용한 목적을 제공하는 것으로 알려져 있지 않다. 그러나 혈액 내 포도당의 농도가 증가함에 따라 Hb A1c로 전환되는 Hb A의 비율이 증가한다. 일반적으로 혈당이 높은 당뇨병 환자의 경우 Hb A1c 비율도 높다. Hb A와 포도당의 결합 속도가 느리기 때문에 Hb A1c의 비율은 적혈구의 수명(약 120일) 동안 혈당 수준의 가중 평균을 반영한다.[87] 따라서 만성 질환인 제2형 당뇨병의 장기간 조절을 모니터링하기 위해 당화 헤모글로빈 수치를 측정한다. 제2형 당뇨병을 제대로 통제하지 못하면 적혈구 내 당화 헤모글로빈 수치가 높아진다. 정상 기준 범위는 약 4.0~5.9%이다. 달성하기 어렵지만 제2형 당뇨병 환자에게는 7% 미만의 값이 권장된다. 9%를 초과하는 수치는 당화 헤모글로빈의 조절 불량과 관련이 있고, 12%를 초과하는 수치는 매우 불량한 조절과 관련이 있다. 당화 헤모글로빈 수치를 7%에 가깝게 유지하는 당뇨병 환자는(8% 이상인 환자보다) 당뇨병에 수반될 수 있는 합병증을 피할 가능성이 훨씬 더 높다.[88] 또한 당화 헤모글로빈의 증가는 산소에 대한 친화력을 증가시켜 조직에서 산소의 방출을 방해하고 극단적인 경우 저산소증을 유발한다.[89]
헤모글로빈 수치의 상승은 적혈구증가증이라고 불리는 적혈구의 수나 크기의 증가와 관련이 있다. 이러한 상승은 선천성 심장 질환, 폐성심, 폐섬유증, 과도한 적혈구생성인자 또는 적혈구증가증으로 인해 일어날 수 있다.[90] 높은 헤모글로빈 수치는 높은 고도에서의 노출, 흡연, 탈수(인위적으로 헤모글로빈을 농축시키는 것에 의한), 진행성 폐 질환 및 특정 종양으로 인해 일어날 수도 있다.[52]
인도 폰디체리에서 실시된 최근의 연구는 관상동맥 질환에 대한 중요성을 보여준다.[91]
진단용[편집]

헤모글로빈 농도 측정은 일반적으로 전체 혈구 수 측정의 일부로 가장 일반적으로 수행되는 혈액 검사 중 하나이다. 예를 들어, 헤모글로빈 농도 측정은 일반적으로 헌혈 전후에 검사된다. 결과는 g/L, g/dL 또는 mol/L로 보고된다. 1 g/dL은 약 0.6206 mmol/L과 동일하지만 mol/L 단위는 분자의 중합체 상태에 관한 불확실성으로 인해 자주 사용되지 않는다.[92] 16,000 Da의 단일 글로빈 단위 분자량은 사용하는 이 변환인자는 혈액 내 헤모글로빈 농도에 대해 더 일반적이다. 평균 적혈구 헤모글로빈 농도(mean corpuscular hemoglobin concentration, MCHC)의 경우, 64,500 Da의 사량체 중량을 사용하는 변환 계수 0.155가 더 일반적이다.[93] 정상적인 수치는 다음과 같다.
- 남성: 13.8~18.0 g/dL (138~180 g/L 또는 8.56~11.17 mmol/L)
- 여성: 12.1~15.1 g/dL (121~151 g/L 또는 7.51~9.37 mmol/L)
- 어린이: 11~16 g/dL (110~160 g/L 또는 6.83~9.93 mmol/L)
- 임산부: 11~14 g/dL (110 ~140 g/L 또는 6.83~8.69 mmol/L) (임신 중 일반적인 값: 9.5~15)[94]
임산부의 임신 초기 및 임신 후기의 헤모글로빈의 정상 수치는 최소 11 g/dL이어야 하며, 임신 중기에는 최소 10.5 g/dL이어야 한다.[95]
탈수 또는 과수화는 측정된 헤모글로빈 수치에 큰 영향을 미칠 수 있다. 알부민은 수분 공급(수화) 상태를 나타낼 수 있다.
헤모글로빈 농도가 정상보다 낮으면 이를 빈혈이라고 한다. 빈혈은 척추동물에서 헤모글로빈을 포함하고 있는 세포인 적혈구의 크기에 따라 분류된다. 적혈구의 크기가 같으면 "소구성(microcytic)" 빈혈, 크면 "대구성(macrocytic)" 빈혈, 정상이면 "정상구성(normocytic)" 빈혈이라고 한다.
적혈구가 차지하는 혈액량의 비율인 헤마토크릿은 일반적으로 g/dL로 측정된 헤모글로빈 농도의 약 3배이다. 예를 들어 헤모글로빈이 17 g/dL로 측정되면 이는 헤모토크릿이 51%인 것과 비교할 수 있다.[96]
실험실 헤모글로빈 검사 방법은 혈액 샘플(동맥, 정맥 또는 모세혈관)과 혈액학 분석기 및 CO-산소측정기에 대한 분석을 필요로 한다. 또한 맥박 CO-산소측정법이라는 새로운 비침습적 헤모글로빈 검사 방법도 침습적 방법과 비슷한 정확도로 사용할 수 있다.[97]
옥시헤모글로빈 및 디옥시헤모글로빈의 농도는 근적외선 분광법을 사용하여 연속적으로, 국부적으로, 비침습적으로 측정할 수 있다.[98][99][100][101][102] 근적외선 분광법은 머리와 근육 모두에 사용할 수 있다. 이 기술은 엘리트 스포츠 훈련, 인체공학, 재활, 환자 모니터링, 신생아 연구, 기능적 뇌 모니터링, 뇌-컴퓨터 인터페이스, 비뇨기과(방광 수축) 신경학(신경혈관 결합) 등과 같은 연구에 자주 사용된다.
헤모글로빈의 질량은 100년 이상 동안 사용되어 온 비방사성 일산화 탄소(CO) 재호흡 기술을 사용하여 사람에서 측정할 수 있다. 이 기술을 사용하면 소량의 순수 일산화 탄소(CO) 가스가 몇 분 동안 흡입되고 재호흡된다. 재호흡을 하는 동안 일산화 탄소는 적혈구에 존재하는 헤모글로빈과 결합한다. 재호흡 기간 이후 혈액의 일산화 탄소 농도의 증가에 따라 희석 원리를 통해 헤모글로빈의 질량을 결정할 수 있다. 대량의 일산화 탄소 기체는 사람에게 독성이 있지만 혈액량을 검사하는 데 사용되는 일산화 탄소의 양은 담배를 피울 때 흡입하는 양과 동일하다. 연구자들은 일반적으로 맞춤형 재호흡 회로를 사용하지만 데탈로 헬스(Detalo Health)의 데탈로 퍼포먼스(Detalo Performance)는 절차를 자동화하고 더 많은 사용자 그룹이 측정을 할 수 있도록 했다.[103]
혈당 농도의 장기간 조절은 Hb A1c의 농도로 측정할 수 있다. 혈당 수치는 하루 동안 매우 다양하게 나타날 수 있기 때문에 이를 직접적으로 측정하려면 많은 샘플들이 필요하다. Hb A1c은 헤모글로빈 A와 포도당의 비가역적인 반응의 산물이다. 포도당의 농도가 높을수록 Hb A1c가 더 많아진다. 반응이 느리기 때문에 Hb A1c의 비율은 적혈구의 수명(약 120일) 기간 동안 평균적인 혈액 내 포도당의 수준을 나타낸다. Hb A1c의 비율이 6.0% 이하이면 장기간의 혈당 조절이 양호함을 나타내는 반면 7.0% 이상의 값은 조절 이상을 나타낼 가능성을 상승시킨다. 이러한 검사는 당뇨병 환자에게 특히 유용하다.[104]
기능적 자기공명영상(fMRI) 기기는 상자성이기 때문에 자기장에 민감한 디옥시헤모그로빈의 신호를 사용한다. 근적외선 분광법(NIRS)과 결합된 측정은 혈액 산소 수준 의존(BOLD) 신호에 비해 옥시헤모글로빈 신호와 디옥시헤모글로빈 신호 모두와 좋은 상관관계를 보여준다.[105]
운동 추적 및 자체 추적 사용[편집]
헤모글로빈은 비침습적으로 추적되어 스포츠 퍼포먼스와 훈련에 대한 더 나은 이해를 위해 일상 활동에서의 혈액 농축 및 혈액 희석 효과를 추적하는 개별적인 데이터 세트를 구축할 수 있다. 운동 선수들은 종종 지구력과 운동 강도에 대해 우려한다. 센서는 조직을 통해 적색광과 적외선을 광 검출기로 방출하는 발광 다이오드를 사용하며, 광 검출기는 신호를 프로세서로 보내 헤모글로빈 단백질에 의한 빛 흡수를 계산한다.[106] 이 센서는 손가락에 고정되는 작은 감지 장치로 구성된 맥박 산소 측정기와 유사하다.
척추동물이 아닌 생물에서의 헤모글로빈 유사체[편집]
다양한 산소 운반 단백질 및 산소 결합 단백질이 동물계와 식물계 전체에 걸쳐 존재한다. 세균, 원생동물, 균류를 포함한 생물체는 모두 헤모글로빈 유사 단백질을 가지고 있으며, 그 역할은 기체 리간드의 가역적 결합을 포함하는 것으로 알려지고 예측된다. 이러한 단백질 중 상당수는 글로빈과 헴 부분(편평한 포르피린 지지체의 철)을 포함하고 있기 때문에 전체적인 3차 구조가 척추동물의 헤모글로빈의 구조와 매우 다르지만 보통 헤모글로빈이라고 불린다. 특히 하등 동물에서는 "미오글로빈"과 헤모글로빈을 구별하는 것이 불가능한 경우가 많다. 왜냐하면 이들 생물체 중 일부는 근육을 가지고 있지 않기 때문이다. 또는 인식할 수 있는 별도의 순환계가 있지만 산소 운반을 담당하는 순환계가 없을 수도 있다(예: 많은 곤충 및 기타 절지동물). 이 모든 분류군에서 기체 결합을 다루는 헴/글로빈 함유 분자(단량체 글로빈 분자도 포함)를 옥시헤모글로빈이라고 한다. 산소 운반 및 감지를 처리하는 것 외에도 NO, CO2, 황화물, 심지어 혐기성 환경에서 O2를 제거하는 것도 처리할 수 있다.[107] 심지어 철 함유 P450 효소 및 과산화효소와 유사한 방식으로 염소 처리된 물질의 해독을 처리할 수도 있다.

헤모글로빈의 구조는 생물종에 따라 다양하다. 헤모글로빈은 생물의 모든 계에서 생성되지만, 모든 생물체에서 생성되는 것은 아니다. 세균, 원생동물, 조류, 식물과 같은 생물종은 종종 단일 글로빈 헤모글로빈을 가지고 있다. 많은 선형동물, 연체동물, 갑각류는 척추동물의 헤모글로빈 분자보다 훨씬 큰 다중 소단위체 분자를 함유하고 있다. 특히, 균류와 거대 환형동물에서 발견되는 키메라 헤모글로빈은 글로빈과 다른 유형의 단백질을 모두 포함할 수 있다.[14]
생물체에서 가장 눈에 띄는 헤모글로빈의 생성 및 용도 중 하나는 리프티아 파킵틸라(Riftia pachyptila)에서 찾아볼 수 있다. 리프티아 파킵틸라라는 이 거대 관벌레는 길이가 2.4 m에 달하고 해양의 화산 분출구에서 서식한다. 소화관 대신에 이 벌레에는 무게의 절반을 차지하는 세균 개체군이 포함되어 있다. 세균은 열수구의 H2를 물에서 생성된 O2와 산화시켜 H2O와 CO2로부터 양분을 만들기 위한 에너지를 생산한다. 벌레의 상단은 진홍색 부채꼴 구조("깃털")로 물 속으로 뻗어나가고, 세균을 위한 H2S와 O2, 그리고 광합성 식물과 유사한 합성 원료를 사용하기 위한 CO2를 흡수한다. 이 구조는 각각 연관된 헴 구조를 포함하는 최대 144개의 글로빈 사슬을 갖는 몇 가지 매우 복잡한 헤모글로빈의 함량으로 인해 밝은 빨간색이다. 이러한 헤모글로빈은 대부분의 다른 종의 헤모글로빈처럼 황화물에 의해 완전히 "중독"되거나 억제되지 낳고 황화물이 있을 때 산소를 운반할 수 있고 심지어 황화물을 운반할 수 있다는 점에서 주목할 만하다.[108][109]
기타 산소 결합 단백질[편집]
- 미오글로빈
- 미오글로빈은 사람을 포함한 많은 척추동물의 근육 조직에서 발견되며 근육 조직에 뚜렷한 빨간색 또는 어두운 회색을 부여한다. 미오글로빈은 구조와 순서가 헤모글로빈과 매우 유사하지만 사량체는 아니며, 대신 협동적 결합이 결여된 단량체이다. 미오글로빈은 산소를 운반하는 대신 산소를 저장하는 데 사용된다.
- 헤모사이아닌
- 헤모사이아닌은 자연에서 발견되는 두 번째로 흔한 산소 운반 단백질로, 많은 절지동물과 연체동물의 혈액에서 발견된다. 철 헴기 대신 구리 보결분자단을 사용하며 산소화되면 파란색을 띤다.
- 헤메리트린
- 헤메리트린은 일부 해양 무척추동물과 환형동물의 일부 종에서 사용하는 철 함유 비헴 단백질로, 혈액에서 산소를 운반한다. 산소와 결합하면 분홍색/보라색으로 나타나고 그렇지 않으면 투명해진다.
- 클로로크루오린
- 클로로크루오린은 많은 환형동물에서 발견되며 에리트로크루오린과 매우 유사하지만 헴기의 구조는 크게 다르다. 산소와 해리되면 녹색으로 나타나고 산소와 결합하면 빨간색으로 나타난다.
- 바나빈
- 바나빈은 바나듐 크로마젠(vanadium chromagen)으로도 알려져 있으며, 멍게(우렁쉥이)의 혈액에서 발견된다. 이로 인해 한때 금속 원소인 바나듐이 산소 결합 보결분자단으로 사용된다는 가설이 세워졌다. 그러나 선호도에 따라 바나듐을 함유하고 있지만 분명히 산소와 거의 결합하지 않기 때문에 다른 기능을 가지고 있으며, 이는 아직 밝혀지지 않았다(멍게에도 일부 헤모글로빈이 포함하고 있음). 이들은 독소로 작용할 수 있다.
- 에리트로크루오린
- 에리트로크루오린은 지렁이를 포함한 많은 환형동물에서 발견되며, 수십, 아마도 수백 개의 철 및 헴 함유 단백질 소단위체가 함께 결합되어 분자량이 350만 달톤 이상인 단일 단백질 복합체를 포함하는 자유롭게 떠다니는 거대한 혈액 단백질이다.
- 레그헤모글로빈
- 레그헤모글로빈은 질소고정세균과 공생을 하는 콩과식물에서 발견된다. 자주개자리나 대두와 같은 콩과식물에서 뿌리에 있는 질소고정세균은 철 헴을 함유한 산소 결합 단백질인 레그헤모글로빈에 의해 산소로부터 보호된다. 보호되는 특정 효소는 질소고정효소이며, 이는 유리 산소가 있는 상태에서 질소를 환원할 수 없다.
- 코보글로빈
- 코보글로빈은 합성 코발트 기반 포르피린을 함유한 단백질이다. 코보단백질은 산소와 결합하면 무색으로 나타나지만 정맥으로 들어가면 노란색으로 나타난다.
적혈구가 아닌 세포에서의 헤모글로빈[편집]
일부 비적혈구 세포(즉, 적혈구 이외의 세포)에는 헤모글로빈이 포함되어 있다. 뇌에서는 흑색질의 A9 도파민작동성 뉴런, 대뇌 겉질과 해마의 성상교세포, 모든 성숙한 희소돌기아교세포가 여기에 포함된다.[12] 이들 세포의 뇌 헤모글로빈은 "산소 저장을 통해 무산소 상태에서 항상성 메커니즘을 제공할 수 있으며, 이는 에너지 생산에 대한 요구 사항이 높고, 대사 활성이 높은 A9 도파민작동성 뉴런에 특히 중요하다"라고 제안되었다.[12] "A9 도파민작동성 뉴런은 높은 미토콘드리아 활성 외에도 자동 산화 및 모노아민 산화효소(MAO) 매개 도파민의 탈아미노화와 접근 가능한 철의 후속 반응으로 매우 독성이 강한 하이드록실 라디칼 생성을 통한 과산화 수소의 생성으로 인한 강렬한 산화 스트레스를 받고 있기 때문에 무산소 변성의 위험이 특히 클 수 있다"는 사실이 추가로 지적되었다.[12] 이는 파킨슨병에서 이들 세포의 퇴행 위험을 설명할 수 있다.[12] 사후에 이들 세포가 어두워지는 원인(라틴어 이름인 substantia nigra의 유래)은 이들 세포에 있는 헤모글로빈 유래 철분이 아니라 뉴로멜라닌에 의한 것이다.
뇌 외부의 헤모글로빈은 대식세포,[110] 폐포 세포[111] 및 콩팥의 혈관사이세포[112]에서 항산화제 및 철 대사 조절제로서 산소 운반이 아닌 기능을 가지고 있다.
역사, 예술에서[편집]

역사적으로 피의 색과 녹 사이의 연관성은 로마 신화의 전쟁의 신인 마르스(Mars)와 화성과의 연관성과 관련이 있다. 그 이유는 화성이 고대인에게 피를 연상시키는 주황색-빨간색이기 때문이다. 화성의 색깔은 화성 토양의 산소와 결합된 철 화합물로 인한 것이지만, 혈액이 붉은색인 것이 헤모글로빈과 그 산화물의 철 때문이라는 것은 일반적인 오해이다. 철의 배위자화(ligation) 및 산화환원 상태가 포르피린의 pi에서 pi*로 또는 n에서 pi*로의 전자 전이에 영향을 미치고 따라서 광학적 특성이 있지만 붉은색은 실제로 철 그 자체가 아니라 철이 결합된 헤모글로빈의 포르피린 부분에 기인한다.[113]
예술가인 줄리안 보스 안드레아는 2005년에 단백질의 공격을 기반으로 "하트 오브 스틸(헤모글로빈), Heart of Steel (Hemoglobin)"이라는 조각품을 만들었다. 조각품은 유리와 내후성 강철로 만들어졌다. 처음에는 반짝거리며 빛나는 예술 작품이 의도적으로 녹이 슬어가는 과정은 산소가 철과 결합하는 헤모글로빈의 근본적인 화학 반응을 반영한다.[114][115]
몬트리올의 예술가인 니콜라스 바이어(Nicolas Baier)는 헤모글로빈 분자의 구조를 보여주는 스테인리스 스틸 조각품인 "Lustre (Hémoglobine)"를 만들었다. 이는 몬트리올에 있는 맥길 대학교 의료 센터의 연구 센터의 아트리움에 전시되어 있다. 이 조각품의 크기는 약 10 m × 10 m × 10 m이다.[116][117]
같이 보기[편집]
- 카바미노헤모글로빈 (CO2와 결합한 헤모글로빈)
- 카복시헤모글로빈 (CO와 결합한 헤모글로빈)
- 엽록소 (헴기에 Mg2+가 포함됨)
- 일반 혈액 검사
- 헤모글로빈 소단위체 델타
- 헤모글로빈 측정기
- 헴단백질
- 메트헤모글로빈 (페리헤모글리빈 또는 철 Hb)
- 옥시헤모글로빈 (O2가 결합하여 붉은색을 띤다)
- 바스카 착물 – O2에 가역적으로 결합하는 능력으로 유명한 이리듐 유기 금속 착물
- 꼬막 (Tegillarca granosa)
주해[편집]
- ↑ "혈액(blood)"을 의미하는 그리스어 "αἷμα (haîma)" + 라틴어로 "공(ball), 구체(sphere)"를 의미하는 "globus" + "-in", /ˌhiːməˈɡloʊbɪn,
ˈhɛmoʊˌ-/[1][2]
각주[편집]
- ↑ Wells, John C. (2008). 《Longman Pronunciation Dictionary》 3판. Longman. ISBN 978-1-4058-8118-0.
- ↑ Jones, Daniel (2011). Roach, Peter; Setter, Jane; Esling, John, 편집. 《Cambridge English Pronouncing Dictionary》 18순위판. Cambridge University Press. ISBN 978-0-521-15255-6.
- ↑ 가 나 Sidell, Bruce; Kristin O'Brien (2006). “When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes”. 《The Journal of Experimental Biology》 209 (Pt 10): 1791–802. doi:10.1242/jeb.02091. PMID 16651546. S2CID 29978182.
- ↑ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). 《Human Biology and Health》. Englewood Cliffs, New Jersey, US: Prentice Hall. ISBN 978-0-13-981176-0.
- ↑ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). “Is hemoglobin an essential structural component of human erythrocyte membranes?”. 《J Clin Invest》 42 (4): 581–88. doi:10.1172/JCI104747. PMC 289318. PMID 13999462.
- ↑ Dominguez de Villota ED, Ruiz Carmona MT, Rubio JJ, de Andrés S (1981). “Equality of the in vivo and in vitro oxygen-binding capacity of hemoglobin in patients with severe respiratory disease”. 《Br J Anaesth》 53 (12): 1325–28. doi:10.1093/bja/53.12.1325. PMID 7317251. S2CID 10029560.
- ↑ Rhodes, Carl E.; Denault, Deanna; Varacallo, Matthew (2023), “Physiology, Oxygen Transport”, 《StatPearls》 (Treasure Island (FL): StatPearls Publishing), PMID 30855920, 2023년 4월 15일에 확인함
- ↑ Costanzo, Linda S. (2007). 《Physiology》. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7311-9.
- ↑ Patton, Kevin T. (2015년 2월 10일). 《Anatomy and Physiology》. Elsevier Health Sciences. ISBN 978-0-323-31687-3. 2016년 4월 26일에 원본 문서에서 보존된 문서. 2016년 1월 9일에 확인함.
- ↑ Epstein, F. H.; Hsia, C. C. W. (1998). “Respiratory Function of Hemoglobin”. 《New England Journal of Medicine》 338 (4): 239–47. doi:10.1056/NEJM199801223380407. PMID 9435331.
- ↑ Saha, D.; Reddy, K. V. R.; Patgaonkar, M.; Ayyar, K.; Bashir, T.; Shroff, A. (2014). “Hemoglobin Expression in Nonerythroid Cells: Novel or Ubiquitous?”. 《International Journal of Inflammation》 2014 (803237): 1–8. doi:10.1155/2014/803237. PMC 4241286. PMID 25431740.
- ↑ 가 나 다 라 마 Biagioli M, Pinto M, Cesselli D, 외. (2009). “Unexpected expression of alpha- and beta-globin in mesencephalic dopaminergic neurons and glial cells”. 《Proceedings of the National Academy of Sciences of the United States of America》 106 (36): 15454–59. Bibcode:2009PNAS..10615454B. doi:10.1073/pnas.0813216106. PMC 2732704. PMID 19717439.
- ↑ “Blood Tests”. 《National Heart, Lung, and Blood Institute (NHLBI)》. 2019년 4월 9일에 원본 문서에서 보존된 문서. 2019년 4월 27일에 확인함.
- ↑ 가 나 Weber RE, Vinogradov SN (2001). “Nonvertebrate hemoglobins: functions and molecular adaptations”. 《Physiol. Rev.》 81 (2): 569–628. doi:10.1152/physrev.2001.81.2.569. PMID 11274340. S2CID 10863037.
- ↑ “Max Perutz, Father of Molecular Biology, Dies at 87”. 《The New York Times》. 2002년 2월 8일. 2016년 4월 23일에 원본 문서에서 보존된 문서.
- ↑ Engelhart, Johann Friedrich (1825). 《Commentatio de vera materia sanguini purpureum colorem impertientis natura》 (라틴어). Göttingen: Dietrich. 2020년 6월 16일에 원본 문서에서 보존된 문서. 2020년 6월 16일에 확인함.
- ↑ “Engelhard & Rose on the Colouring Matter of the Blood”. 《Edinburgh Medical and Surgical Journal》 27 (90): 95–102. 1827. PMC 5763191. PMID 30330061.
- ↑ Adair, Gilbert Smithson (1925). “A critical study of the direct method of measuring the osmotic pressure of hǣmoglobin”. 《Proc. R. Soc. Lond.》. A 108 (750): 292–300. Bibcode:1925RSPSA.109..292A. doi:10.1098/rspa.1925.0126.
- ↑ Parry, CH (1794). 《Letters from Dr. Withering, ... Dr. Ewart, ... Dr. Thorton ... and Dr. Biggs ... together with some other papers, supplementary to two publications on asthma, consumption, fever, and other diseases, by T. Beddoes》 (영어). Google Books. 43쪽. 2022년 1월 31일에 원본 문서에서 보존된 문서. 2021년 11월 30일에 확인함.
- ↑ Beddoes, T (1796). 《Considerations on the Medicinal Use, and on the Production of Factitious Airs: Part I. By Thomas Beddoes, M.D. Part II. By James Watt, Engineer; "Part 1, section 2, "Of the breathing of man and familiar animals"》 (영어). Bulgin and Rosser. Part 1, p. 9–13쪽. 2022년 1월 31일에 원본 문서에서 보존된 문서. 2021년 11월 30일에 확인함.
- ↑ Hünefeld, Friedrich Ludwig (1840). 《Der Chemismus in der thierischen Organisation》 (독일어). Leipzig: F. A. Brockhaus. 2021년 4월 14일에 원본 문서에서 보존된 문서. 2021년 2월 26일에 확인함.
- ↑ Funke O (1851). “Über das milzvenenblut”. 《Z Rat Med》 1: 172–218.
- ↑ “A NASA Recipe For Protein Crystallography” (PDF). 《Educational Brief》. National Aeronautics and Space Administration. 2008년 4월 10일에 원본 문서 (PDF)에서 보존된 문서. 2008년 10월 12일에 확인함.
- ↑ Hoppe-Seyler F (1866). “Über die oxydation in lebendem blute”. 《Med-chem Untersuch Lab》 1: 133–40.
- ↑ 가 나 Stoddart, Charlotte (2022년 3월 1일). “Structural biology: How proteins got their close-up”. 《Knowable Magazine》. doi:10.1146/knowable-022822-1. 2022년 3월 25일에 확인함.
- ↑ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). “Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis”. 《Nature》 185 (4711): 416–22. Bibcode:1960Natur.185..416P. doi:10.1038/185416a0. PMID 18990801. S2CID 4208282.
- ↑ Perutz MF (1960). “Structure of haemoglobin”. 《Brookhaven Symposia in Biology》 13: 165–83. PMID 13734651.
- ↑ de Chadarevian, Soraya (June 2018). “John Kendrew and myoglobin: Protein structure determination in the 1950s: John Kendrew and Myoglobin”. 《Protein Science》 27 (6): 1136–1143. doi:10.1002/pro.3417. PMC 5980623. PMID 29607556.
- ↑ 가 나 Hardison, Ross C. (2012년 12월 1일). “Evolution of hemoglobin and its genes”. 《Cold Spring Harbor Perspectives in Medicine》 2 (12): a011627. doi:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
- ↑ Offner, Susan (2010년 4월 1일). “Using the NCBI Genome Databases to Compare the Genes for Human & Chimpanzee Beta Hemoglobin”. 《The American Biology Teacher》 (영어) 72 (4): 252–56. doi:10.1525/abt.2010.72.4.10. ISSN 0002-7685. S2CID 84499907. 2019년 12월 26일에 원본 문서에서 보존된 문서. 2019년 12월 26일에 확인함.
- ↑ “HBB – Hemoglobin subunit beta – Pan paniscus (Pygmy chimpanzee) – HBB gene & protein”. 《www.uniprot.org》. 2020년 8월 1일에 원본 문서에서 보존된 문서. 2020년 3월 10일에 확인함.
- ↑ “HBA1 – Hemoglobin subunit alpha – Pan troglodytes (Chimpanzee) – HBA1 gene & protein”. 《www.uniprot.org》. 2020년 8월 1일에 원본 문서에서 보존된 문서. 2020년 3월 10일에 확인함.
- ↑ 가 나 Huisman THJ (1996). “A Syllabus of Human Hemoglobin Variants”. 《Globin Gene Server》. Pennsylvania State University. 2008년 12월 11일에 원본 문서에서 보존된 문서. 2008년 10월 12일에 확인함.
- ↑ Hemoglobin Variants 보관됨 2006-11-05 - 웨이백 머신. Labtestsonline.org. Retrieved 2013-09-05.
- ↑ Uthman, MD, Ed. “Hemoglobinopathies and Thalassemias”. 2007년 12월 15일에 원본 문서에서 보존된 문서. 2007년 12월 26일에 확인함.
- ↑ Reed, Leslie. "Adaptation found in mouse genes." Omaha World-Herald, 11 Aug. 2009: EBSCO. [쪽 번호 필요]
- ↑ “Mammoths had ′anti-freeze′ blood”. BBC. 2010년 5월 2일. 2010년 5월 4일에 원본 문서에서 보존된 문서. 2010년 5월 2일에 확인함.
- ↑ Projecto-Garcia, Joana; Natarajan, Chandrasekhar; Moriyama, Hideaki; Weber, Roy E.; Fago, Angela; Cheviron, Zachary A.; Dudley, Robert; McGuire, Jimmy A.; Witt, Christopher C. (2013년 12월 17일). “Repeated elevational transitions in hemoglobin function during the evolution of Andean hummingbirds”. 《Proceedings of the National Academy of Sciences》 110 (51): 20669–74. Bibcode:2013PNAS..11020669P. doi:10.1073/pnas.1315456110. ISSN 0027-8424. PMC 3870697. PMID 24297909.
- ↑ Beall, Cynthia M.; Song, Kijoung; Elston, Robert C.; Goldstein, Melvyn C. (2004년 9월 28일). “Higher offspring survival among Tibetan women with high oxygen saturation genotypes residing at 4,000 m”. 《Proceedings of the National Academy of Sciences of the United States of America》 101 (39): 14300–04. Bibcode:2004PNAS..10114300B. doi:10.1073/pnas.0405949101. ISSN 0027-8424. PMC 521103. PMID 15353580.
- ↑ “Hemoglobin Synthesis”. 2002년 4월 14일. 2007년 12월 26일에 원본 문서에서 보존된 문서. 2007년 12월 26일에 확인함.
- ↑ Burka, Edward (1969). “Characteristics of RNA degradation in the erythroid cell”. 《The Journal of Clinical Investigation》 48 (7): 1266–72. doi:10.1172/jci106092. PMC 322349. PMID 5794250.
- ↑ 가 나 Van Kessel, Hans (2002). 〈Proteins – Natural Polyamides〉. 《Nelson Chemistry 12》. Toronto: Thomson. 122쪽. ISBN 978-0-17-625986-0.
- ↑ "Hemoglobin Tutorial." 보관됨 2009-11-26 - 웨이백 머신 University of Massachusetts Amherst. Web. 23 Oct. 2009.
- ↑ Steinberg, MH (2001). 《Disorders of Hemoglobin: Genetics, Pathophysiology, and Clinical Management》. Cambridge University Press. 95쪽. ISBN 978-0-521-63266-9. 2016년 11월 17일에 원본 문서에서 보존된 문서. 2016년 2월 18일에 확인함.
- ↑ Hardison, RC (1996). “A brief history of hemoglobins: plant, animal, protist, and bacteria”. 《Proc Natl Acad Sci USA》 93 (12): 5675–79. Bibcode:1996PNAS...93.5675H. doi:10.1073/pnas.93.12.5675. PMC 39118. PMID 8650150.
- ↑ "Hemoglobin." 보관됨 2009-11-13 - 웨이백 머신 School of Chemistry – Bristol University – UK. Web. 12 Oct. 2009.
- ↑ WikiPremed > Coordination Chemistry 보관됨 2009-08-23 - 웨이백 머신. Retrieved July 2, 2009
- ↑ Basic Biology (2015). “Blood cells”. 2021년 7월 18일에 원본 문서에서 보존된 문서. 2020년 3월 27일에 확인함.
- ↑ Linberg R, Conover CD, Shum KL, Shorr RG (1998). “Hemoglobin based oxygen carriers: how much methemoglobin is too much?”. 《Artif Cells Blood Substit Immobil Biotechnol》 26 (2): 133–48. doi:10.3109/10731199809119772. PMID 9564432.
- ↑ Hemoglobin 보관됨 2017-03-15 - 웨이백 머신. Worthington-biochem.com. Retrieved 2013-09-05.
- ↑ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG (2001). “Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle”. 《J Appl Physiol》 90 (2): 511–19. doi:10.1152/jappl.2001.90.2.511. PMID 11160049. S2CID 15468862.
- ↑ 가 나 "Hemoglobin." 보관됨 2012-01-24 - 웨이백 머신 MedicineNet. Web. 12 Oct. 2009.
- ↑ "Hemoglobin Home." 보관됨 2009-12-01 - 웨이백 머신 Biology @ Davidson. Web. 12 Oct. 2009.
- ↑ “Hemoglobin saturation graph”. altitude.org. 2010년 8월 31일에 원본 문서에서 보존된 문서. 2010년 7월 6일에 확인함.
- ↑ King, Michael W. “The Medical Biochemistry Page – Hemoglobin”. 2012년 3월 4일에 원본 문서에서 보존된 문서. 2012년 3월 20일에 확인함.
- ↑ Voet, D. (2008) Fundamentals of Biochemistry, 3rd. ed., Fig. 07_06, John Wiley & Sons. ISBN 0470129301
- ↑ Shikama K (2006). “Nature of the FeO2 bonding in myoglobin and hemoglobin: A new molecular paradigm”. 《Prog Biophys Mol Biol》 91 (1–2): 83–162. doi:10.1016/j.pbiomolbio.2005.04.001. PMID 16005052.
- ↑ Ahrens; Kimberley, Basham (1993). 《Essentials of Oxygenation: Implication for Clinical Practice》. Jones & Bartlett Learning. 194쪽. ISBN 978-0-86720-332-5.
- ↑ Ogawa, S; Menon, R. S.; Tank, D. W.; Kim, S. G.; Merkle, H; Ellermann, J. M.; Ugurbil, K (1993). “Functional brain mapping by blood oxygenation level-dependent contrast magnetic resonance imaging. A comparison of signal characteristics with a biophysical model”. 《Biophysical Journal》 64 (3): 803–12. Bibcode:1993BpJ....64..803O. doi:10.1016/S0006-3495(93)81441-3. PMC 1262394. PMID 8386018.
- ↑ 가 나 Bren KL, Eisenberg R, Gray HB (2015). “Discovery of the magnetic behavior of hemoglobin: A beginning of bioinorganic chemistry”. 《Proc Natl Acad Sci U S A》 112 (43): 13123–27. Bibcode:2015PNAS..11213123B. doi:10.1073/pnas.1515704112. PMC 4629386. PMID 26508205.
- ↑ 가 나 Goodman, Morris; Moore, G. William; Matsuda, Genji (1975년 2월 20일). “Darwinian evolution in the genealogy of haemoglobin”. 《Nature》 253 (5493): 603–08. Bibcode:1975Natur.253..603G. doi:10.1038/253603a0. PMID 1089897. S2CID 2979887.
- ↑ 가 나 다 Storz, Jay F.; Opazo, Juan C.; Hoffmann, Federico G. (2013년 2월 1일). “Gene duplication, genome duplication, and the functional diversification of vertebrate globins”. 《Molecular Phylogenetics and Evolution》 66 (2): 469–78. doi:10.1016/j.ympev.2012.07.013. ISSN 1095-9513. PMC 4306229. PMID 22846683.
- ↑ 가 나 Pillai, Arvind S.; Chandler, Shane A.; Liu, Yang; Signore, Anthony V.; Cortez-Romero, Carlos R.; Benesch, Justin L. P.; Laganowsky, Arthur; Storz, Jay F.; Hochberg, Georg K. A.; Thornton, Joseph W. (May 2020). “Origin of complexity in haemoglobin evolution”. 《Nature》 (영어) 581 (7809): 480–85. Bibcode:2020Natur.581..480P. doi:10.1038/s41586-020-2292-y. ISSN 1476-4687. PMC 8259614. PMID 32461643. S2CID 218761566.
- ↑ Zimmer, E. A.; Martin, S. L.; Beverley, S. M.; Kan, Y. W.; Wilson, A. C. (1980년 4월 1일). “Rapid duplication and loss of genes coding for the alpha chains of hemoglobin”. 《Proceedings of the National Academy of Sciences of the United States of America》 77 (4): 2158–62. Bibcode:1980PNAS...77.2158Z. doi:10.1073/pnas.77.4.2158. ISSN 0027-8424. PMC 348671. PMID 6929543.
- ↑ Mihailescu, Mihaela-Rita; Russu, Irina M. (2001년 3월 27일). “A signature of the T → R transition in human hemoglobin”. 《Proceedings of the National Academy of Sciences of the United States of America》 98 (7): 3773–77. Bibcode:2001PNAS...98.3773M. doi:10.1073/pnas.071493598. ISSN 0027-8424. PMC 31128. PMID 11259676.
- ↑ Chou KC (1989). “Low-frequency resonance and cooperativity of hemoglobin”. 《Trends Biochem. Sci.》 14 (6): 212–13. doi:10.1016/0968-0004(89)90026-1. PMID 2763333.
- ↑ Jensen, Frank B (2009). “The dual roles of red blood cells in tissue oxygen delivery: oxygen carriers and regulators of local blood flow”. 《Journal of Experimental Biology》 212 (Pt 21): 3387–93. doi:10.1242/jeb.023697. PMID 19837879. S2CID 906177.
- ↑ Hall, John E. (2010). 《Guyton and Hall textbook of medical physiology》 12판. Philadelphia, Pa.: Saunders/Elsevier. 502쪽. ISBN 978-1-4160-4574-8.
- ↑ Forget, B. G.; Bunn, H. F. (2013년 2월 1일). “Classification of the Disorders of Hemoglobin”. 《Cold Spring Harbor Perspectives in Medicine》 (Cold Spring Harbor Laboratory) 3 (2): a011684. doi:10.1101/cshperspect.a011684. ISSN 2157-1422. PMC 3552344. PMID 23378597.
- ↑ Rhodes, Carl E.; Varacallo, Matthew (2019년 3월 4일). “Physiology, Oxygen Transport”. 《NCBI Bookshelf》. PMID 30855920. 2021년 8월 27일에 원본 문서에서 보존된 문서. 2019년 5월 4일에 확인함.
It is important to note that in the setting of carboxyhemoglobinemia, it is not a reduction in oxygen-carrying capacity that causes pathology, but an impaired delivery of bound oxygen to target tissues.
- ↑ Nelson, D. L.; Cox, M. M. (2000). Lehninger Principles of Biochemistry, 3rd ed. New York: Worth Publishers. p. 217, ISBN 1572599316.
- ↑ Guyton, Arthur C.; John E. Hall (2006). 《Textbook of Medical Physiology》 11판. Philadelphia: Elsevier Saunders. 511쪽. ISBN 978-0-7216-0240-0.
- ↑ Lecture – 12 Myoglobin and Hemoglobin - 유튜브
- ↑ 《Biochemistry》 Eigh판. New York: W. H. Freeman. 2015. ISBN 978-1-4641-2610-9.[쪽 번호 필요]
- ↑ Rutjes, H. A.; Nieveen, M. C.; Weber, R. E.; Witte, F.; Van den Thillart, G. E. E. J. M. (2007년 6월 20일). “Multiple strategies of Lake Victoria cichlids to cope with lifelong hypoxia include hemoglobin switching”. 《AJP: Regulatory, Integrative and Comparative Physiology》 293 (3): R1376–83. doi:10.1152/ajpregu.00536.2006. PMID 17626121.
- ↑ Gronenborn, Angela M.; Clore, G.Marius; Brunori, Maurizio; Giardina, Bruno; Falcioni, Giancarlo; Perutz, Max F. (1984). “Stereochemistry of ATP and GTP bound to fish haemoglobins”. 《Journal of Molecular Biology》 178 (3): 731–42. doi:10.1016/0022-2836(84)90249-3. PMID 6492161.
- ↑ Weber, Roy E.; Frank B. Jensen (1988). “Functional adaptations in hemoglobins from ectothermic vertebrates”. 《Annual Review of Physiology》 50: 161–79. doi:10.1146/annurev.ph.50.030188.001113. PMID 3288089.
- ↑ Rang, H.P.; Dale M.M.; Ritter J.M.; Moore P.K. (2003). 《Pharmacology, Fifth Edition》. Elsevier. ISBN 978-0-443-07202-4.[쪽 번호 필요]
- ↑ “Hemoglobin Variants”. 《Lab Tests Online》. American Association for Clinical Chemistry. 2007년 11월 10일. 2008년 9월 20일에 원본 문서에서 보존된 문서. 2008년 10월 12일에 확인함.
- ↑ Kikuchi, G.; Yoshida, T.; Noguchi, M. (2005). “Heme oxygenase and heme degradation”. 《Biochemical and Biophysical Research Communications》 338 (1): 558–67. doi:10.1016/j.bbrc.2005.08.020. PMID 16115609.
- ↑ Coomes, Marguerite W. (2011). 〈Amino Acid and Heme Metabolism〉. Devlin, Thomas M. 《Textbook of Biochemistry: With Clinical Correlations》 7판. Hoboken, NJ: John Wiley & Sons. 797쪽. ISBN 978-0-470-28173-4.
- ↑ "hemoglobinopathy" - 돌란드 의학사전
- ↑ hypoxemia 보관됨 2009-02-02 - 웨이백 머신. Encyclopædia Britannica, stating hypoxemia (reduced oxygen tension in the blood).
- ↑ Biology-Online.org --> Dictionary » H » Hypoxemia 보관됨 2009-11-21 - 웨이백 머신 last modified 29 December 2008
- ↑ William, C. Wilson; Grande, Christopher M.; Hoyt, David B. (2007). 〈Pathophysiology of acute respiratory failure〉. 《Trauma, Volume II: Critical Care》. Taylor & Francis. 430쪽. ISBN 978-1-4200-1684-0. 2016년 11월 17일에 원본 문서에서 보존된 문서. 2016년 2월 18일에 확인함.
- ↑ McGaffigan, P. A. (1996). “Hazards of hypoxemia: How to protect your patient from low oxygen levels”. 《Nursing》 26 (5): 41–46; quiz 46. doi:10.1097/00152193-199626050-00013. PMID 8710285.
- ↑ “NGSP: HbA1c and eAG”. 《www.ngsp.org》. 2015년 10월 15일에 원본 문서에서 보존된 문서. 2015년 10월 28일에 확인함.
- ↑ "Definition of Glycosylated Hemoglobin." 보관됨 2014-01-23 - 웨이백 머신 Medicine Net. Web. 12 Oct. 2009.
- ↑ Madsen, H; Ditzel, J (1984). “Blood-oxygen transport in first trimester of diabetic pregnancy”. 《Acta Obstetricia et Gynecologica Scandinavica》 63 (4): 317–20. doi:10.3109/00016348409155523. PMID 6741458. S2CID 12771673.
- ↑ Hemoglobin 보관됨 2016-06-10 - 웨이백 머신 at Medline Plus
- ↑ Padmanaban, P.; Toora, B. (2011). “Hemoglobin: Emerging marker in stable coronary artery disease”. 《Chronicles of Young Scientists》 2 (2): 109. doi:10.4103/2229-5186.82971.
- ↑ Society for Biomedical Diabetes Research. SI Unit Conversion Calculator 보관됨 2013-03-09 - 웨이백 머신.
- ↑ Handin, Robert I.; Lux, Samuel E. and StosselBlood, Thomas P. (2003). Blood: Principles & Practice of Hematology. Lippincott Williams & Wilkins, ISBN 0781719933
- ↑ Although other sources can have slightly differing values, such as haemoglobin (reference range) 보관됨 2009-09-25 - 웨이백 머신. gpnotebook.co.uk
- ↑ Murray S.S. & McKinney E.S. (2006). Foundations of Maternal-Newborn Nursing. 4th ed., p. 919. Philadelphia: Saunders Elsevier. ISBN 1416001417.
- ↑ “Hematocrit (HCT) or Packed Cell Volume (PCV)”. DoctorsLounge.com. 2008년 1월 2일에 원본 문서에서 보존된 문서. 2007년 12월 26일에 확인함.
- ↑ Frasca, D.; Dahyot-Fizelier, C.; Catherine, K.; Levrat, Q.; Debaene, B.; Mimoz, O. (2011). “Accuracy of a continuous noninvasive hemoglobin monitor in intensive care unit patients*”. 《Critical Care Medicine》 39 (10): 2277–82. doi:10.1097/CCM.0b013e3182227e2d. PMID 21666449. S2CID 205541592.
- ↑ Ferrari, M.; Binzoni, T.; Quaresima, V. (1997). “Oxidative metabolism in muscle”. 《Philosophical Transactions of the Royal Society B: Biological Sciences》 352 (1354): 677–83. Bibcode:1997RSPTB.352..677F. doi:10.1098/rstb.1997.0049. PMC 1691965. PMID 9232855.
- ↑ Madsen, P. L.; Secher, N. H. (1999). “Near-infrared oximetry of the brain”. 《Progress in Neurobiology》 58 (6): 541–60. doi:10.1016/S0301-0082(98)00093-8. PMID 10408656. S2CID 1092056.
- ↑ McCully, K. K.; Hamaoka, T. (2000). “Near-infrared spectroscopy: What can it tell us about oxygen saturation in skeletal muscle?”. 《Exercise and Sport Sciences Reviews》 28 (3): 123–27. PMID 10916704.
- ↑ Perrey, S. P. (2008). “Non-invasive NIR spectroscopy of human brain function during exercise”. 《Methods》 45 (4): 289–99. doi:10.1016/j.ymeth.2008.04.005. PMID 18539160.
- ↑ Rolfe, P. (2000). “Invivonear-Infraredspectroscopy”. 《Annual Review of Biomedical Engineering》 2: 715–54. doi:10.1146/annurev.bioeng.2.1.715. PMID 11701529.
- ↑ Siebenmann, Christoph; Keiser, Stefanie; Robach, Paul; Lundby, Carsten (2017년 6월 29일). “CORP: The assessment of total hemoglobin mass by carbon monoxide rebreathing”. 《Journal of Applied Physiology》 123 (3): 645–654. doi:10.1152/japplphysiol.00185.2017. ISSN 8750-7587. PMID 28663373.
- ↑ This Hb A1c level is only useful in individuals who have red blood cells (RBCs) with normal survivals (i.e., normal half-life). In individuals with abnormal RBCs, whether due to abnormal hemoglobin molecules (such as Hemoglobin S in Sickle Cell Anemia) or RBC membrane defects – or other problems, the RBC half-life is frequently shortened. In these individuals, an alternative test called "fructosamine level" can be used. It measures the degree of glycation (glucose binding) to albumin, the most common blood protein, and reflects average blood glucose levels over the previous 18–21 days, which is the half-life of albumin molecules in the circulation.
- ↑ Mehagnoul-Schipper DJ, van der Kallen BF, Colier WN, van der Sluijs MC, van Erning LJ, Thijssen HO, Oeseburg B, Hoefnagels WH, Jansen RW (2002). “Simultaneous measurements of cerebral oxygenation changes during brain activation by near-infrared spectroscopy and functional magnetic resonance imaging in healthy young and elderly subjects”. 《Hum Brain Mapp》 16 (1): 14–23. doi:10.1002/hbm.10026. PMC 6871837. PMID 11870923.
- ↑ “Cercacor – How Ember's non-invasive hemoglobin technology works”. 《technology.cercacor.com》. 2016년 11월 4일에 원본 문서에서 보존된 문서. 2016년 11월 3일에 확인함.
- ↑ L. Int Panis; B. Goddeeris; R Verheyen (1995). “The hemoglobin concentration of Chironomus cf.Plumosus L. (Diptera: Chironomidae) larvae from two lentic habitats”. 《Netherlands Journal of Aquatic Ecology》 29 (1): 1–4. Bibcode:1995NJAqE..29....1P. doi:10.1007/BF02061785. S2CID 34214741. 2018년 9월 5일에 원본 문서에서 보존된 문서. 2013년 11월 10일에 확인함.
- ↑ Zal F, Lallier FH, Green BN, Vinogradov SN, Toulmond A (1996). “The multi-hemoglobin system of the hydrothermal vent tube worm Riftia pachyptila. II. Complete polypeptide chain composition investigated by maximum entropy analysis of mass spectra”. 《J. Biol. Chem.》 271 (15): 8875–81. doi:10.1074/jbc.271.15.8875. PMID 8621529.
- ↑ Minic Z, Hervé G (2004). “Biochemical and enzymological aspects of the symbiosis between the deep-sea tubeworm Riftia pachyptila and its bacterial endosymbiont”. 《Eur. J. Biochem.》 271 (15): 3093–102. doi:10.1111/j.1432-1033.2004.04248.x. PMID 15265029.
- ↑ Liu L, Zeng M, Stamler JS (1999). “Hemoglobin induction in mouse macrophages”. 《Proceedings of the National Academy of Sciences of the United States of America》 96 (12): 6643–47. Bibcode:1999PNAS...96.6643L. doi:10.1073/pnas.96.12.6643. PMC 21968. PMID 10359765.
- ↑ Newton DA, Rao KM, Dluhy RA, Baatz JE (2006). “Hemoglobin Is Expressed by Alveolar Epithelial Cells”. 《Journal of Biological Chemistry》 281 (9): 5668–76. doi:10.1074/jbc.M509314200. PMID 16407281.
- ↑ Nishi, H.; Inagi, R.; Kato, H.; Tanemoto, M.; Kojima, I.; Son, D.; Fujita, T.; Nangaku, M. (2008). “Hemoglobin is Expressed by Mesangial Cells and Reduces Oxidant Stress”. 《Journal of the American Society of Nephrology》 19 (8): 1500–08. doi:10.1681/ASN.2007101085. PMC 2488266. PMID 18448584.
- ↑ Boh, Larry (2001). 《Pharmacy Practice Manual: A Guide to the Clinical Experience》. Lippincott Williams & Wilkins. ISBN 978-0-7817-2541-5.
- ↑ Holden, Constance (2005). “Blood and Steel”. 《Science》 309 (5744): 2160. doi:10.1126/science.309.5744.2160d. S2CID 190178048.
- ↑ Moran L, Horton RA, Scrimgeour G, Perry M (2011). 《Principles of Biochemistry》. Boston, MA: Pearson. 127쪽. ISBN 978-0-321-70733-8.
- ↑ Henry, Sean (2014년 8월 7일). “Take a sneak peek at the MUHC's art collection”. CBC News. 2016년 2월 5일에 원본 문서에서 보존된 문서. 2016년 2월 1일에 확인함.
- ↑ “Lustre (Hémoglobine) 2014”. 《Art Public Montréal》. Montréal. 2016년 2월 1일에 원본 문서에서 보존된 문서. 2016년 2월 1일에 확인함.
더 읽을거리[편집]
| 헤모글로빈 관련 도서관 자료 |
- Campbell, MK (1999). 《Biochemistry》 i판. Harcourt. ISBN 978-0-03-024426-1.
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. 《Am Heart J》 151 (1): 91.e1–91.e6. doi:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Ganong, WF (2003). 《Review of Medical Physiology》 21판. Lange. ISBN 978-0-07-140236-1.
- Hager, T (1995). 《Force of Nature: The Life of Linus Pauling》. Simon and Schuster. ISBN 978-0-684-80909-0.
- Hazelwood, Loren (2001) Can't Live Without It: The story of hemoglobin in sickness and in health, Nova Science Publishers ISBN 1-56072-907-4
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. 《J Mol Biol》 356 (2): 335–53. doi:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. 《Cold Spring Harbor Perspectives in Medicine》 2 (12): a011627. doi:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
외부 링크[편집]
- National Anemia Action Council at anemia.org
- New hemoglobin type causes mock diagnosis with pulse oxymeters 보관됨 2016-03-09 - 웨이백 머신 at www.life-of-science.net 보관됨 2017-03-07 - 웨이백 머신
