입체화학
이 문서의 내용은 출처가 분명하지 않습니다. (2008년 9월) |
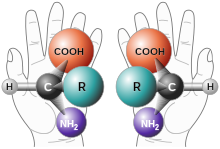
입체화학(立體化學, 영어: stereochemistry)이란 분자의 3차원적인 구조 또는 이와 관려한 현상을 밝히는 방법론과 거기에 유래하는 물성론 등을 포함한 학문 영역이다. 입체 화학(立體化學)은 화학의 한 분야로 분자 안의 원자 또는 원자단의 공간적 배치를 입체적으로 고려하여 여러 가지 현상을 연구하는 학문이다. 이러한 맥락(context)에서 입체화학적특이성(立體化學的特異性)은 생체 내에서 입체 화학적인 이성체 가운데 하나만을 특이적으로 대사하거나 합성하는 성질을 가리킨다.
이처럼 화학물질의 입체적인 구조는 그 물성에 지대한 영향을 미친다. 그러므로 입체화학은 화학 중에서도 제일 기본적이고 중요한 항목이다. 그러나 너무나도 기본적인 분야이기 때문에 강의과목명과 교과서명에는 자주 쓰이면서 자신을 '입체화학자'로 칭하는 사람은 거의 없다.
개요[편집]
한 분자에서 그를 구성하고 있는 원소의 종류와 수를 표시한 것이 분자식이다. 그러나 같은 분자식을 가지고 있더라도 각 원자끼리의 결합의 종류와 방향, 즉 3차원적 분자 구조가 틀려지면 전혀 성질이 다른 분자가 된다. 이렇게 같은 분자식을 가지고 있으면서 구조가 다른 것을 이성질체라고 한다. 또한 분자가 이성질체로 변화하는 것을 이성화라고 한다.
이성질체는 크게 구조이성질체와 입체이성질체로 나눈다. 입체이성질체는 다시 부분입체이성질체와 거울상 이성질체로 크게 구분된다.
입체이성질체의 원인이 되는, 라세미체라고 한다. 이것은 광학활성을 전혀 보이지 않으나 한 쪽의 거울상 이성질체가 많으면 광학활성을 나타낸다. 화학 합성에서 어느 한쪽의 거울상 이성질체를 선택적으로 합성하는 것을 부제합성이라고 한다.
기하 이성질체[편집]
기하 이성질체는 부분입체 이성질체중 특히 구성원자와 결합관계는 같으나 공간적인 구조가 달라서 보통의 조건으로는 서로 변환이 가능하지 않은 이성질체를 말한다. 이중결합을 가지고 있는 물질의 E-와 Z-, 정팔면체형 착물의 cis-와 trans- 등의 예가 있다.
부분입체 이성질체[편집]
부분입체 이성질체란 입체 중심을 여러 개 가지고 있는 화합물 중에서 거울상이 아닌 이성질체를 총칭하여 말한다. 예를 들자면 2개의 입체 생성 중심 탄소를 가지는 화합물에서 RR과 RS의 관계를 말한다. 경우에 따라선 erythro/threo, syn/anti등의 용어를 사용하는 경우도 있다. 한편, 2개이상의 부제탄소를 지니는 화합물의 경우에도, 분자 내에 대칭면이 존재하는 경우 광학활성을 보이지 않으며 이런 화합물을 메조 화합물이라고 부른다. 부분입체 이성질체 중에 특히 한 곳만 입체 배열이 틀려지는 것들을 에피머, 에피머가 되는 것을 에피머화라고 한다. 또한 당 화합물에서는 아노머가 생성된다.
입체배열[편집]
입체배열이란 원자단의 상대적인 입체배치를 말하는데 단일결합 주위의 회전처럼 원자단 간의 관계가 결합의 끊어짐 없이 자유롭게 변화하는 경우를 이야기 한다. 비고리성 화합물의 경우 단일결합을 중심으로 이웃한 원자단간의 관계를 고쉬, 에클립스, 스태거드등으로 분류할 수 있으며, 시클로헥산 등의 고리성화합물에서는 고리성화합물에 연결된 원자단과 고리성화합물이 만들어내는 평면사이의 관계에 따라 액시얼, 이퀴토리얼, 슈도액시얼, 슈도이퀴토리얼등으로 분류할 수 있다.
입체화학의 결정법[편집]
단순한 유기화합물의 경우엔 NMR로 거의 완전히 입체화학을 결정할 수 있다. 요즘 들어서는 신 모셔법 등의 발전에 의해 절대 입체배치도 결정할 수 있게 되었다. 그러나 현재는 X선 구조분석을 하는 것이 가장 확실하다.
