아라키돈산

| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
(5Z,8Z,11Z,14Z)-5,8,11,14-Eicosatetraenoic acid
| |||
| 체계명
(5Z,8Z,11Z,14Z)-Icosa-5,8,11,14-tetraenoic acid[1] | |||
| 별칭
5,8,11,14-all-cis-Eicosatetraenoic acid; all-cis-5,8,11,14-Eicosatetraenoic acid; Arachidonate
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 1713889 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.007.304 | ||
| EC 번호 |
| ||
| 58972 | |||
| KEGG | |||
| MeSH | Arachidonic+acid | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C20H32O2 | |||
| 몰 질량 | 304.474 g·mol−1 | ||
| 밀도 | 0.922 g/cm3 | ||
| 녹는점 | −49 °C (−56 °F; 224 K) | ||
| 끓는점 | 169 to 171 °C (336 to 340 °F; 442 to 444 K) at 0.15 mmHg | ||
| log P | 6.994 | ||
| 산성도 (pKa) | 4.752 | ||
| 위험 | |||
| GHS 그림문자 | 
| ||
| 신호어 | 경고 | ||
| H302, H312, H315, H319, H332, H335 | |||
| P261, P264, P270, P271, P280, P301+312, P302+352, P304+312, P304+340, P305+351+338, P312, P321, P322, P330, P332+313, P337+313, P362, P363, P403+233, P405, P501 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | 113 °C (235 °F; 386 K) | ||
| 관련 화합물 | |||
관련 화합물
|
Eicosatetraenoic acid | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
아라키돈산(영어: arachidonic acid)은 20:4 ω-6 또는 20:4(5,8,11,14)로 표기되는 다불포화 지방산 및 오메가-6 지방산이다.[2] 아라키돈산은 쿠푸아수 버터에서 발견되는 포화 지방산인 아라키드산과 구조적으로 관련되어 있다.[3]
화학[편집]
화학 구조에서 아라키돈산은 20개의 탄소로 구성된 사슬에 4개의 시스 이중 결합을 가지고 있는 카복실산으로 첫 번째 이중 결합이 오메가 말단에서부터 6번째 탄소에 위치한다.
일부 화학 문헌은 일부 에이코사테트라엔산을 지정하기 위해 아라키돈산을 정의한다. 그러나, 생물학, 의학, 영양학의 거의 모든 문헌들은 아라키돈산을 올-시스-5,8,11,14-에이코사테트라엔산으로 제한해서 정의한다.
생물학[편집]
아라키돈산은 신체를 구성하는 세포의 세포막에 있는 인지질(특히, 포스파티딜에탄올아민, 포스파티딜콜린, 포스파티딜이노시톨)에 존재하는 다불포화 지방산이며, 뇌, 근육 및 간에 풍부하다. 골격근은 특히 인지질의 지방산 함량 중 아라키돈산이 대략 10~20%를 차지하는 아라키돈산을 많이 보유하고 있는 조직이다.[4]
PLC-γ, PLC-δ, PKC-α, PKC-β, PKC-γ와 같은 신호전달 효소의 조절에 관여하는 지질 2차 전달자로서 세포 신호전달에 관여하는 것 외에, 아라키돈산은 주요 염증성 중간생성물이며, 또한 혈관확장제로 작용할 수도 있다.[5]
조건부 필수 지방산[편집]

아라키돈산은 필수 지방산이 아니다. 그러나 리놀레산이 부족하거나 리놀레산을 아라키돈산으로 전환할 수 없는 경우에는 아라키돈산을 필요로 하게 된다. 일부 포유류는 리놀레산을 아라키돈산으로 전환시키는 능력이 부족하거나 능력이 매우 제한되어 있어 먹이를 섭취할 때 필수적인 부분이 된다. 아라키돈산은 일반적인 식물에서 거의 또는 전혀 발견되지 않기 때문에 이에 해당하는 동물들은 육식동물이다. 고양이들은 필수 지방산을 불포화시키는 능력이 결여되어 있다.[6][7] 아라키돈산의 상업적인 공급원은 균류인 모르티엘레라 알피나(Mortierella alpina)이다.[8]
사람에서 합성 및 캐스케이드[편집]
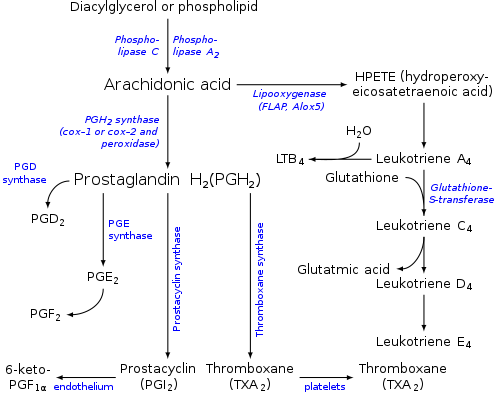 |
아라키돈산은 지방산을 분해하는 효소인 포스포라이페이스 A2(PLA2)에 의해 인지질 분자로부터 유리되지만, 다이아실글리세롤 라이페이스에 의해 다이아실글리세롤로부터 생성될 수도 있다.[5]
신호전달 목적으로 생성된 아라키돈산은 세포질 포스포라이페이스 A2(cPLA2, 85 kDa)의 작용에 의해 유도되는 반면, 염증성 아라키돈산은 저분자량 분비 포스포라이페이스 A2(sPLA2, 14~18 kDa)의 작용에 의해 생성된다.[5]
아라키돈산은 생물학적 및 임상적으로 중요한 에이코사노이드 및 이들 에이코사노이드의 대사산물들의 전구체이다.
- 아라키돈산은 사이클로옥시제네이스-1 및 사이클로옥시제네이스-2(즉, 프로스타글란딘 G/H 생성효소 1(PTGS1) 및 프로스타글란딘 G/H 생성효소 2(PTGS2))에 의해 프로스타글란딘 G2 및 프로스타글란딘 H2로 대사되며, 이는 차례로 다양한 프로스타글란딘, 프로스타사이클린, 트롬복산 및 프로스타글란딘 G2/H2, 12-하이드록시헵타데카트라이엔산(12-HHT)의 트롬복산 대사의 17-탄소 생성물로 전환될 수 있다.[9][10]
- 아라키돈산은 아라키돈산 5-리폭시제네이스에 의해 5-하이드로퍼옥시에이코사트라이엔산(5-HPETE)으로 대사되고, 이는 차례로 다양한 류코트라이엔들(즉, 류코트라이엔 B4, 류코트라이엔 C4, 류코트라이엔 D4 및 류코트라이엔 E4 뿐만 아니라 5-하이드록시에이코사테트라엔산(5-HETE)으로 대사된다. 이는 이어서 5-하이드록시에이코사테트라엔산보다 강력한 5-케토 유사체, 5-옥소-에이코사테트라엔산으로 대사될 수 있다.[11]
- 아라키돈산은 15-리폭시제네이스-1(ALOX15) 및 15-리폭시제네이스-2(ALOX15B)에 의해 15-하이드로퍼옥시에이코사테트라엔산(15-HPETE)로 대사된 다음, 15-하이드록시에이코사테트라엔산(15-HETE) 및 리폭신으로 대사될 수 있다.[12][13][14] 15-리폭시제네이스-1은 또한 15-하이드로퍼옥시에이코사테트라엔산을 류코트라이엔으로 대사하는 경로와 유사한 경로에서 15-하이드로퍼옥시에이코사테트라엔산을 에옥신으로 대사할 수 있다.[15]
- 아라키돈산은 아라키돈산 12-리폭시제네이스(ALOX12)에 의해 12-하이드로퍼옥시에이코사테트라엔산(12-HPETE)으로 대사된 다음, 12-하이드록시에이코사테트라엔산(12-HETE) 및 헤폭실린으로 대사될 수 있다.[16]
- 아라키돈산은 또한 아난다마이드의 생합성에 사용된다.[17]
- 일부 아라키돈산은 에폭시제네이스에 의해 하이드록시에이코사테트라엔산(HETE) 및 에폭시에이코사트라이엔산(EET)으로 전환된다.[18]
신체에서 아라키돈산의 유도체들의 생성과 그 작용을 통칭하여 아라키돈산 캐스케이드라고 한다.
포스포라이페이스 A2의 활성화[편집]
포스포라이페이스 A2는 다음과 같은 수용체에 대한 리간드 결합에 의해 활성화된다.
- 5-HT2 수용체[19]
- 대사성 글루탐산 수용체 1(mGLUR1)[19]
- 염기성 섬유아세포 생장인자(bFGF) 수용체[19]
- 인터페론-α 수용체[19]
- 인터페론-γ 수용체[19]
더욱이, 세포 내 칼슘을 증가시키는 모든 물질은 어떤 형태의 포스포라이페이스 A2의 활성화를 유발할 수 있다.[20]
포스포라이페이스 C의 활성화[편집]
대안적으로 포스포라이페이스 C가 이노시톨 삼중인산을 절단하여 다이아실글리세롤을 생성한 다음에 인지질로부터 아라키돈산이 분해될 수 있으며, 이어서 다이아실글리세롤 라이페이스에 의해 절단되어 아라키돈산을 생성한다.[19]
이 경로를 활성화시키는 수용체들은 다음과 같다.
포스포라이페이스 C는 또한 MAP 키네이스에 의해 활성화될 수 있다. 이 경로의 활성화제는 혈소판 유래 생장인자(PDGF)와 섬유아세포 생장인자(FGF)를 포함한다.[20]
신체에서[편집]
근육 생장[편집]
아라키돈산은 운동 중 및 운동 후에 프로스타글란딘인 프로스타글란딘 F2α로의 전환을 통해 골격근 조직의 복구 및 생장을 촉진한다.[21] 프로스타글란딘 F2α는 류신, β-하이드록시 β-메틸뷰티르산 및 포스파티드산과 유사하게 Akt/mTOR 경로[21]를 통해 신호전달을 하여 근육 단백질의 합성을 촉진한다.
뇌[편집]
아라키돈산은 뇌에 가장 풍부한 지방산들 중 하나이며, 도코사헥사엔산(DHA)과 비슷한 양으로 존재한다. 아라키돈산과 도코사헥사엔산은 뇌의 지방산 함량의 약 20%를 차지한다.[22] 도코사헥사엔산과 마찬가지로, 신경계의 건강은 충분한 수준의 아라키돈산에 의존하고 있다. 무엇보다도 아라키돈산은 해마의 세포막 유동성을 유지하는데 도움을 준다.[23] 또한 아라키돈산은 퍼옥시좀 증식체 활성화 수용체 감마(PPAR-γ)를 활성화하여 산화적 스트레스로부터 뇌를 보호하는 데 도움을 준다.[24] 아라키돈산은 또한 뉴런의 생장 및 복구에 관여하는 단백질인 신택신-3를 활성화시킨다.[25]
아라키돈산은 또한 초기 신경 발생에 관여한다. 한 연구에서 17주 동안 아라키돈산 보충제를 투여받은 영아(18개월)는 정신 발달 지수에 의해 측정된 바와 같이 지능이 상당히 개선되었음을 보여주었다.[26] 이러한 효과는 아라키돈산과 도코사헥사엔산을 동시에 보충함으로써 더욱 강화된다.
어른의 경우 아라키돈산의 대사 이상은 알츠하이머병과 양극성 장애와 같은 신경정신적 질환과 관련이 있다.[27] 이러한 조건에서 아라키돈산은 다른 생체활성 분자로 전환(아라키돈산 효소 캐스케이드에서의 과발현 또는 이상)시키는 데 상당한 변화가 있다는 증거가 있다.
알츠하이머병[편집]
아라키돈산과 알츠하이머병의 발병에 대한 어떤 연구는 아라키돈산과 그 대사산물이 알츠하이머병의 발병과 관련이 있음을 시사하는 반면,[28] 다른 연구는 알츠하이머병의 초기 단계에서 아라키돈산의 보충이 증상을 줄이고 질병의 진행을 늦추는 데 효과적일 수 있다고 제안하는 등 혼합된 결과를 보여주었다.[29] 알츠하이머병 환자를 위한 아라키돈산 보충에 대한 추가적인 연구가 필요하다. 또 다른 연구는 대기 오염이 염증의 원인이고, 아라키돈산의 대사산물은 염증을 촉진시켜 세포 손상의 신호를 면역계로 전달한다고 지적했다.[30]
보디빌딩 보충제[편집]
아라키돈산은 다양한 제품에서 동화성 보디빌딩 보충제로 판매된다. 아라키돈산의 보충(8주 동안 1,500 mg/일)은 경험이 많은 단련된 남성에서 제지방체중, 체력, 힘을 증가시키는 것으로 나타났다. 이는 탬파 대학교의 위약 대조 실험에서 입증되었다. 30명의 남성(20.4 ± 2.1세)은 아라키돈산 또는 위약을 8주간 복용하면서, 통제된 저항 훈련 프로그램에 참가했다. 8주 후에 아라키돈산을 복용한 그룹(1.62 kg 증가)이 위약을 복용한 그룹(0.09 kg 증가)에 비해 제지방체중이 현저하게 더 증가(p<0.05)하였다. 근육 두께의 변화도 위약군(0.25 cm 증가)보다 아라키돈산군(0.47 cm 증가)에서 더 컸다(p<0.05). 무산소 일률도 위약군(738.75 → 766.51 W)에 비해 아라키돈산군(723.01 → 800.66 W)에서 더 크게 증가했다. 마지막으로 전체 힘의 변화는 위약군(75.78 lbs.)에 비해 아라키돈산군(109.92 lbs.)에서 유의미하게 더 컸다. 이러한 결과는 아라키돈산의 보충이 저항 훈련된 남성에서 근력 및 골격근 비대에 적응을 긍정적으로 증강시킬 수 있음을 시사한다.[31]
50일 동안 아라키돈산 1,000 mg/일의 효과를 조사한 초기 임상 연구에서 운동 중인 남성에서 무산소 운동 용량 및 운동 기능을 향상시키는 보충제로 발견되었다. 이러한 연구 동안, 윈게이트(Wingate) 상대 피크 파워에서 상당한 그룹-시간 상호작용의 효과가 관찰되었다(AA: 1.2 ± 0.5; P: -0.2 ± 0.2 W•kg-1, p=0.015). 통계자료는 벤치 프레스 1RM (AA: 11.0 ± 6.2; P: 8.0 ± 8.0 kg, p=0.20), 윈게이트 평균 파워(AA:37.9 ± 10.0; P: 17.0 ± 24.0 W, p=0.16) 및 윈게이트 전체 일(AA: 1292 ± 1206; P: 510 ± 1249 J, p=0.087)에서도 나타났다. 저항 훈련 중 아라키돈산의 보충은 다른 성능 관련 변수가 중요도에 근접하면서 상대 피크 전력의 상당한 증가를 촉진했다. 이러한 발견들은 아라키돈산을 근육의 힘과 사이즈, 그리고 파워 능력을 향상시키는 물질로 사용하는 것을 지지한다.[32]
식이 아라키돈산 및 염증[편집]
아라키돈산의 섭취 증가는 지질 과산화 생성물이 혼합되지 않는 한 정상적인 대사 조건에서는 염증을 일으키지 않는다. 아라키돈산은 염증 반응 동안 및 염증 반응 후에 각각 전염증성 및 항염증성 에이코사노이드로 대사된다. 아라키돈산은 또한 생장을 촉진하기 위해 신체 활동 중 및 신체 활동 후에 염증성 및 항염증성 에이코사노이드로 대사된다. 그러나 외인성 독소 및 과도한 운동으로 인한 만성 염증은 운동으로 인한 급성 염증 및 조직의 미세한 상처의 회복 및 생장을 촉진하기 위한 염증 반응과 혼동하지 말아야 한다.[33] 그러나 증거들은 서로 엇갈린다. 건강한 사람에게 하루에 840 mg과 2,000 mg을 50일 동안 투여한 일부 연구에서는 염증이나 관련대사 활동이 증가하지 않는 것으로 나타났다.[33][34][35][36] 그러나 다른 연구들은 아라키돈산의 수치가 증가하면 실제로 전염증성 인터루킨-6 및 인터루킨-1 수치가 감소하고 항염증성 종양괴사인자-β와 관련이 있다는 것을 보여준다.[37] 이것은 전신의 염증을 감소시킬 수 있다.
아라키돈산은 부상 및 많은 질병 상태와 관련된 염증에서 중심적인 역할을 한다. 신체에서 대사되는 방식은 염증 또는 항염증 활성을 나타낸다. 관절 통증이나 활동성 염증성 질환을 앓고 있는 사람은 아라키돈산의 섭취 증가가 증상을 악화시킨다는 것을 알 수 있는데, 이는 아마도 염증성 화합물로 보다 쉽게 전환되기 때문이다. 마찬가지로 염증성 병력이 있거나 건강이 손상된 사람에게는 아라키돈산의 많은 섭취가 권장되지 않는다. 아라키돈산의 보충은 건강한 사람에게 전염증 효과가 없는 것으로 보이지만, 오메가-3 지방산 보충제의 항염증 효과에 대항할 수도 있다.[38]
아라키돈산 보충이 건강에 미치는 효과[편집]
50일 동안 매일 1,000~1,500 mg의 아라키돈산의 섭취는 몇몇 임상 연구에서 잘 용인되어 왔으며, 심각한 부작용은 보고되지 않았다. 신장 및 간 기능,[35] 혈장 지질,[39] 면역,[40] 혈소판 응집[34]을 포함한 모든 일반적인 건강 지표는 이러한 용량과 사용기간에 영향을 받지 않는 것으로 보인다. 또한, 근육 조직에서 더 높은 농도의 아라키돈산은 인슐린 민감도 개선과 상관관계가 있을 수 있다.[41] 건강한 성인의 식단에서 아라키돈산의 보충은 독성이나 심각한 안전상의 위험을 제공하지 않는 것으로 보인다.
활동량이 많지 않은 피험자를 대상으로 한 아라키돈산 보충에 대한 연구는 일일 최대 1,500 mg의 용량에서 염증성 마커의 변화를 발견하지 못했지만, 강도에 따른 훈련을 받은 피험자는 다르게 반응할 수 있다. 한 연구는 저항 운동과 병행하여 50일 동안 아라키돈산을 하루에 1,000 mg씩 보충하는 젊은 남성들의 염증(마커 인터루킨-6를 통한)이 현저하게 감소했다고 보고했다. 이것은 내성 훈련을 받는 동안 아라키돈산을 보충하면 실제로 전신 염증 조절이 개선될 수 있음을 시사한다.[42]
심장 질환의 위험과 개별 지방산들 사이의 연관성을 찾고 있는 메타 분석은 오메가-6 지방산인 아라키돈산 뿐만 아니라 오메가-3 지방산들인 에이코사펜타엔산(EPA)와 도코사헥사엔산(DHA)의 높은 수치를 가진 사람에서 심장 질환의 위험이 현저하게 감소했다고 보고했다.[43] 미국 심장협회의 과학적인 자문도 아라키돈산을 포함한 식이 오메가-6 지방산의 건강에 미치는 영향을 호의적으로 평가했다.[33] 이 단체는 필수 지방산을 제한할 것을 권고하지 않는다. 실제로 이 논문은 아라키돈산을 포함한 오메가-6 지방산이 전체 칼로리의 5~10%를 차지하는 식단을 따를 것을 권고하고 있다. 이는 아라키돈산이 심장 질환의 위험 인자가 아니며, 최적의 물질대사를 유지하고, 심장 질환의 위험을 줄이는 데 역할을 할 수 있음을 시사한다. 따라서 건강을 최적의 상태로 유지하기 위해서 오메가-3 지방산과 오메가-6 지방산의 섭취 수준을 충분히 유지하는 것이 좋다.
아라키돈산은 발암물질이 아니며, 섭취량은 암의 발병 위험성과 관련이 없다는 연구 결과가 있다.[44][45][46][47] 그러나 아라키돈산은 염증 및 세포 생장 과정에 필수불가결한 존재로, 암을 포함한 많은 종류의 질병과 관련이 있다. 따라서, 암, 염증 또는 다른 질병을 앓고 있는 환자에서 아라키돈산 보충의 안전성은 알려져 있지 않으며, 아라키돈산 보충이 권장되지 않는다.
같이 보기[편집]
- 아스피린: 사이클로옥시제네이스를 저해하여, 아라키돈산이 다른 신호분자로 전환되는 것을 방지함.
- 생선기름
- 다불포화 지방
- 다불포화 지방산
각주[편집]
- ↑ Pubchem. “5,8,11,14-Eicosatetraenoic acid | C20H32O2 - PubChem”. 《pubchem.ncbi.nlm.nih.gov》. 2016년 3월 31일에 확인함.
- ↑ “IUPAC Lipid nomenclature: Appendix A: names of and symbols for higher fatty acids”. 《www.sbcs.qmul.ac.uk》. 2018년 8월 9일에 원본 문서에서 보존된 문서. 2019년 10월 24일에 확인함.
- ↑ “Dorland's Medical Dictionary – 'A'”. 2007년 1월 11일에 원본 문서에서 보존된 문서. 2007년 1월 12일에 확인함.
- ↑ Smith, GI; Atherton, P; Reeds, DN; Mohammed, BS; Rankin, D; Rennie, MJ; Mittendorfer, B (Sep 2011). “Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women.”. 《Clinical Science》 121 (6): 267–78. doi:10.1042/cs20100597. PMC 3499967. PMID 21501117.
- ↑ 가 나 다 Baynes, John W.; Marek H. Dominiczak (2005). 《Medical Biochemistry 2nd. Edition》. Elsevier Mosby. 555쪽. ISBN 0-7234-3341-0.
- ↑ MacDonald, ML; Rogers, QR; Morris, JG (1984). “Nutrition of the Domestic Cat, a Mammalian Carnivore”. 《Annual Review of Nutrition》 4: 521–62. doi:10.1146/annurev.nu.04.070184.002513. PMID 6380542.
- ↑ Rivers, JP; Sinclair, AJ; Craqford, MA (1975). “Inability of the cat to desaturate essential fatty acids”. 《Nature》 258 (5531): 171–3. Bibcode:1975Natur.258..171R. doi:10.1038/258171a0. PMID 1186900.
- ↑ Production of life'sARA™ Archived 2016년 7월 1일 - 웨이백 머신, www.lifesdha.com/
- ↑ Wlodawer, P; Samuelsson, B (1973). “On the organization and mechanism of prostaglandin synthetase”. 《The Journal of Biological Chemistry》 248 (16): 5673–8. PMID 4723909.
- ↑ Smith, W. L.; Song, I (2002). “The enzymology of prostaglandin endoperoxide H synthases-1 and -2”. 《Prostaglandins & other lipid mediators》. 68–69: 115–28. doi:10.1016/s0090-6980(02)00025-4. PMID 12432913.
- ↑ Powell, W. S.; Rokach, J (Apr 2015). “Biosynthesis, biological effects, and receptors of hydroxyeicosatetraenoic acids (HETEs) and oxoeicosatetraenoic acids (oxo-ETEs) derived from arachidonic acid”. 《Biochim Biophys Acta》 1851 (4): 340–355. doi:10.1016/j.bbalip.2014.10.008. PMC 5710736. PMID 25449650.
- ↑ Brash, A. R.; Boeglin, W. E.; Chang, M. S. (Jun 1997). “Discovery of a second 15S-lipoxygenase in humans”. 《Proc Natl Acad Sci U S A》 94 (12): 6148–52. Bibcode:1997PNAS...94.6148B. doi:10.1073/pnas.94.12.6148. PMC 21017. PMID 9177185.
- ↑ Zhu, D; Ran, Y (May 2012). “Role of 15-lipoxygenase/15-hydroxyeicosatetraenoic acid in hypoxia-induced pulmonary hypertension”. 《J Physiol Sci》 62 (3): 163–72. doi:10.1007/s12576-012-0196-9. PMID 22331435.
- ↑ Romano, M; Cianci, E; Simiele, F; Recchiuti, A (Aug 2015). “Lipoxins and aspirin-triggered lipoxins in resolution of inflammation”. 《Eur J Pharmacol》 760: 49–63. doi:10.1016/j.ejphar.2015.03.083. PMID 25895638.
- ↑ Feltenmark, S; Gautam, N; Brunnström, A; Griffiths, W; Backman, L; Edenius, C; Lindbom, L; Björkholm, M; Claesson, H. E. (Jan 2008). “Eoxins are proinflammatory arachidonic acid metabolites produced via the 15-lipoxygenase-1 pathway in human eosinophils and mast cells”. 《Proc Natl Acad Sci U S A》 105 (2): 680–5. Bibcode:2008PNAS..105..680F. doi:10.1073/pnas.0710127105. PMC 2206596. PMID 18184802.
- ↑ Porro, B; Songia, P; Squellerio, I; Tremoli, E; Cavalca, V (Aug 2014). “Analysis, physiological and clinical significance of 12-HETE: A neglected platelet-derived 12-lipoxygenase product”. 《J Chromatogr B》 964: 26–40. doi:10.1016/j.jchromb.2014.03.015. PMID 24685839.
- ↑ Ueda, Natsuo; Tsuboi, Kazuhito; Uyama, Toru (May 2013). “Metabolism of endocannabinoids and related N -acylethanolamines: Canonical and alternative pathways”. 《FEBS J.》 280 (9): 1874–94. doi:10.1111/febs.12152. PMID 23425575.
- ↑ Walter F., PhD. Boron (2003). 《Medical Physiology: A Cellular And Molecular Approaoch》. Elsevier/Saunders. 108쪽. ISBN 1-4160-2328-3.
- ↑ 가 나 다 라 마 바 Walter F., PhD. Boron (2003). 《Medical Physiology: A Cellular And Molecular Approaoch》. Elsevier/Saunders. 103쪽. ISBN 1-4160-2328-3.
- ↑ 가 나 다 라 마 바 Walter F., PhD. Boron (2003). 《Medical Physiology: A Cellular And Molecular Approaoch》. Elsevier/Saunders. 104쪽. ISBN 1-4160-2328-3.
- ↑ 가 나 Trappe TA, Liu SZ (2013). “Effects of prostaglandins and COX-inhibiting drugs on skeletal muscle adaptations to exercise”. 《J. Appl. Physiol.》 115 (6): 909–19. doi:10.1152/japplphysiol.00061.2013. PMC 3764617. PMID 23539318.
- ↑ Crawford, MA; Sinclair, AJ (1971). “Nutritional influences in the evolution of mammalian brain. In: lipids, malnutrition & the developing brain”. 《Ciba Foundation symposium》: 267–92. PMID 4949878.
- ↑ Fukaya, T.; Gondaira, T.; Kashiyae, Y.; Kotani, S.; Ishikura, Y.; Fujikawa, S.; Kiso, Y.; Sakakibara, M. (2007). “Arachidonic acid preserves hippocampal neuron membrane fluidity in senescent rats”. 《Neurobiology of Aging》 28 (8): 1179–1186. doi:10.1016/j.neurobiolaging.2006.05.023. PMID 16790296.
- ↑ Wang, ZJ; Liang, CL; Li, GM; Yu, CY; Yin, M (2006). “Neuroprotective effects of arachidonic acid against oxidative stress on rat hippocampal slices”. 《Chemico-Biological Interactions》 163 (3): 207–17. doi:10.1016/j.cbi.2006.08.005. PMID 16982041.
- ↑ Darios, F; Davletov, B (2006). “Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3”. 《Nature》 440 (7085): 813–7. Bibcode:2006Natur.440..813D. doi:10.1038/nature04598. PMID 16598260.
- ↑ Birch, Eileen E; Garfield, Sharon; Hoffman, Dennis R; Uauy, Ricardo; Birch, David G (2007). “A randomized controlled trial of early dietary supply of long-chain polyunsaturated fatty acids and mental development in term infants”. 《Developmental Medicine & Child Neurology》 42 (3): 174–181. doi:10.1111/j.1469-8749.2000.tb00066.x.
- ↑ Rapoport, SI (2008). “Arachidonic acid and the brain”. 《The Journal of Nutrition》 138 (12): 2515–20. PMC 3415870. PMID 19022981.
- ↑ Amtul, Z.; Uhrig, M.; Wang, L.; Rozmahel, R. F.; Beyreuther, K. (2012). “Detrimental effects of arachidonic acid and its metabolites in cellular and mouse models of Alzheimer's disease: Structural insight”. 《Neurobiology of Aging》 33 (4): 831.e21–31. doi:10.1016/j.neurobiolaging.2011.07.014. PMID 21920632.
- ↑ Schaeffer, EL; Forlenza, OV; Gattaz, WF (2009). “Phospholipase A2 activation as a therapeutic approach for cognitive enhancement in early-stage Alzheimer disease”. 《Psychopharmacology》 202 (1–3): 37–51. doi:10.1007/s00213-008-1351-0. PMID 18853146.
- ↑ Calderón-Garcidueñas, L; Reed, W; Maronpot, R. R.; Henríquez-Roldán, C; Delgado-Chavez, R; Calderón-Garcidueñas, A; Dragustinovis, I; Franco-Lira, M; Aragón-Flores, M; Solt, A. C.; Altenburg, M; Torres-Jardón, R; Swenberg, J. A. (2004). “Brain inflammation and Alzheimer's-like pathology in individuals exposed to severe air pollution”. 《Toxicologic Pathology》 32 (6): 650–8. doi:10.1080/01926230490520232. PMID 15513908.
- ↑ Ormes, Jacob. “Effects of Arachidonic Acid Supplementation on Skeletal Muscle Mass, Strength, and Power”. 《NSCA ePoster Gallery》. National Strength and Conditioning Association. 2018년 9월 9일에 원본 문서에서 보존된 문서. 2019년 10월 24일에 확인함.
- ↑ Roberts, MD; Iosia, M; Kerksick, CM; Taylor, LW; Campbell, B; Wilborn, CD; Harvey, T; Cooke, M; Rasmussen, C; Greenwood, Mike; Wilson, Ronald; Jitomir, Jean; Willoughby, Darryn; Kreider, Richard B (2007). “Effects of arachidonic acid supplementation on training adaptations in resistance-trained males”. 《Journal of the International Society of Sports Nutrition》 4: 21. doi:10.1186/1550-2783-4-21. PMC 2217562. PMID 18045476.
- ↑ 가 나 다 Harris, WS; Mozaffarian, D; Rimm, E; Kris-Etherton, P; Rudel, LL; Appel, LJ; Engler, MM; Engler, MB; Sacks, F (2009). “Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention”. 《Circulation》 119 (6): 902–7. doi:10.1161/CIRCULATIONAHA.108.191627. PMID 19171857.
- ↑ 가 나 Nelson, GJ; Schmidt, PC; Bartolini, G; Kelley, DS; Kyle, D (1997). “The effect of dietary arachidonic acid on platelet function, platelet fatty acid composition, and blood coagulation in humans”. 《Lipids》 32 (4): 421–5. doi:10.1007/s11745-997-0055-7. PMID 9113631.
- ↑ 가 나 Changes in whole blood and clinical safety markers over 50 days of concomitant arachidonic acid supplementation and resistance training 보관됨 2011-07-07 - 웨이백 머신. Wilborn, C, M Roberts, C Kerksick, M Iosia, L Taylor, B Campbell, T Harvey, R Wilson, M. Greenwood, D Willoughby and R Kreider. Proceedings of the International Society of Sports Nutrition (ISSN) Conference June 15–17, 2006.
- ↑ Pantaleo, P; Marra, F; Vizzutti, F; Spadoni, S; Ciabattoni, G; Galli, C; La Villa, G; Gentilini, P; Laffi, G (2004). “Effects of dietary supplementation with arachidonic acid on platelet and renal function in patients with cirrhosis”. 《Clinical Science》 106 (1): 27–34. doi:10.1042/CS20030182. PMID 12877651.
- ↑ Ferrucci, L; Cherubini, A; Bandinelli, S; Bartali, B; Corsi, A; Lauretani, F; Martin, A; Andres-Lacueva, C; Senin, U; Guralnik, JM (2006). “Relationship of plasma polyunsaturated fatty acids to circulating inflammatory markers”. 《The Journal of Clinical Endocrinology and Metabolism》 91 (2): 439–46. doi:10.1210/jc.2005-1303. PMID 16234304.
- ↑ Li, B; Birdwell, C; Whelan, J (1994). “Antithetic relationship of dietary arachidonic acid and eicosapentaenoic acid on eicosanoid production in vivo”. 《Journal of Lipid Research》 35 (10): 1869–77. PMID 7852864.
- ↑ Nelson, GJ; Schmidt, PC; Bartolini, G; Kelley, DS; Phinney, SD; Kyle, D; Silbermann, S; Schaefer, EJ (1997). “The effect of dietary arachidonic acid on plasma lipoprotein distributions, apoproteins, blood lipid levels, and tissue fatty acid composition in humans”. 《Lipids》 32 (4): 427–33. doi:10.1007/s11745-997-0056-6. PMID 9113632.
- ↑ Kelley, DS; Taylor, PC; Nelson, GJ; MacKey, BE (1998). “Arachidonic acid supplementation enhances synthesis of eicosanoids without suppressing immune functions in young healthy men” (PDF). 《Lipids》 33 (2): 125–30. doi:10.1007/s11745-998-0187-9. PMID 9507233.
- ↑ Borkman, M; Storlien, LH; Pan, DA; Jenkins, AB; Chisholm, DJ; Campbell, LV (1993). “The relation between insulin sensitivity and the fatty-acid composition of skeletal-muscle phospholipids”. 《The New England Journal of Medicine》 328 (4): 238–44. doi:10.1056/NEJM199301283280404. PMID 8418404.
- ↑ Roberts, MD; Iosia, M; Kerksick, CM; Taylor, LW; Campbell, B; Wilborn, CD; Harvey, T; Cooke, M; Rasmussen, C; Greenwood, M; Wilson, R; Jitomir, J; Willoughby, D; Kreider, RB (2007년 11월 28일). “Effects of arachidonic acid supplementation on training adaptations in resistance-trained males.”. 《Journal of the International Society of Sports Nutrition》 4: 21. doi:10.1186/1550-2783-4-21. PMC 2217562. PMID 18045476.
- ↑ Chowdhury, R; Warnakula, S; Kunutsor, S; Crowe, F; Ward, HA; Johnson, L; Franco, OH; Butterworth, AS; Forouhi, NG; Thompson, SG; Khaw, KT; Mozaffarian, D; Danesh, J; Di Angelantonio, E (2014년 3월 18일). “Association of dietary, circulating, and supplement fatty acids with coronary risk: a systematic review and meta-analysis.”. 《Annals of Internal Medicine》 160 (6): 398–406. doi:10.7326/M13-1788. PMID 24723079.
- ↑ Schuurman, AG; Van Den Brandt, PA; Dorant, E; Brants, HA; Goldbohm, RA (1999). “Association of energy and fat intake with prostate carcinoma risk: results from The Netherlands Cohort Study”. 《Cancer》 86 (6): 1019–27. doi:10.1002/(SICI)1097-0142(19990915)86:6<1019::AID-CNCR18>3.0.CO;2-H. PMID 10491529.
- ↑ Leitzmann, MF; Stampfer, MJ; Michaud, DS; Augustsson, K; Colditz, GC; Willett, WC; Giovannucci, EL (2004). “Dietary intake of n-3 and n-6 fatty acids and the risk of prostate cancer”. 《The American Journal of Clinical Nutrition》 80 (1): 204–16. PMID 15213050.
- ↑ Astorg, P (2005). “Dietary fatty acids and colorectal and prostate cancers: epidemiological studies”. 《Bulletin du cancer》 92 (7): 670–84. PMID 16123006.
- ↑ Whelan, J; McEntee, MF (2004). “Dietary (n-6) PUFA and intestinal tumorigenesis”. 《The Journal of Nutrition》 134 (12 Suppl): 3421S–3426S. PMID 15570048.
외부 링크[편집]
- Arachidonic Acid at acnp.org
- 의학주제표목 (MeSH)의 Arachidonic+Acid