폴리인산염
폴리인산염(영어: polyphosphate)은 산소 원자를 공유하며 함께 연결된 사면체 PO4(인산염) 구조 단위로부터 형성된 고분자 산소 음이온의 염 또는 에스터이다. 폴리인산염은 선형 또는 고리형 구조를 가질 수 있다. 생물학에서 폴리인산 에스터인 ADP와 ATP는 에너지 저장에 관여한다. 다양한 폴리인산염은 도시 수역에서 광물 격리에 사용되며, 일반적으로 1~5 ppm으로 존재한다.[1] GTP, CTP, UTP는 각각 단백질 합성, 지질 합성 및 탄수화물 대사에서 중요한 뉴클레오타이드이다. 폴리인산염은 E452로 표시된 식품 첨가물로도 사용된다.
구조[편집]
-
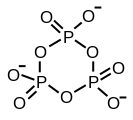
고리형 트라이메타인산염
-
아데노신 이인산 (ADP)
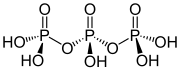
트라이폴리인산의 구조는 폴리인산염의 구조를 정의하는 원리를 설명한다. 이는 산소 중심을 공유하여 함께 연결된 3개의 사면체 PO4 단위로 구성된다. 선형 사슬인 경우 말단인 그룹은 하나의 산화물을 공유하고 다른 인 중심은 두 개의 산화 중심을 공유한다. 해당하는 인산염은 산성 양성자의 소실로 인해 산과 관련된다. 순환 삼량체의 경우 각 사면체는 인접한 사면체와 두 개의 꼭짓점을 공유한다.
3개의 모서리의 공유가 가능하다. 이 모티프는 선형 중합체의 가교를 나타낸다. 가교된 폴리인산염은 시트 구조의 필로실리케이트를 채택하지만, 이러한 구조는 극한의 조건 하에서만 채택된다.
형성 및 합성[편집]
폴리인산염은 인산 유도체의 중합에 의해 생성된다. 이 과정은 축합 반응에서 두 개의 인산염 단위로 시작된다.
- 2 H(PO4)2−
 (P2O7)4− + H2O
(P2O7)4− + H2O
이의 역반응인 가수분해도 가능하기 때문에 축합은 평형으로 나타낼 수 있다. 과정은 단계적으로 계속될 수 있다. 각 단계에서 또 다른 (PO3)− 단위가 사슬에 추가된다. P4O10은 각 사면체가 다른 사면체와 세 모서리를 공유하는 축합 반응의 최종 생성물로 볼 수 있다. 반대로 오산화 인에 소량의 물을 첨가하면 복잡한 고분자 혼합물이 생성된다.
산-염기 및 복합체 특성[편집]
폴리인산염은 약염기이다. 산소 원자의 고립 전자쌍은 전형적인 루이스 산-루이스 염기 상호작용에서 수소 이온(양성자) 또는 금속 이온에 공여될 수 있다. 이것은 생물학에서 중요한 의미를 갖는다. 예를 들어 아데노신 삼인산(ATP)은 pH 7의 수용액에서 약 25% 정도 양성자화된다.[2]
- ATP4− + H+
 ATPH3−, pKa 6.6
ATPH3−, pKa 6.6
더 낮은 pH에서 추가적인 양성자화가 일어난다.
고에너지 인산 결합[편집]
ATP는 금속 이온과 킬레이트 착물을 형성한다. 평형에 대한 안정도 상수는 특히 크다.[3]
- ATP4− + Mg2+
 MgATP2−, log β 4
MgATP2−, log β 4
ATP의 가수분해는 말단 인산기와 분자의 나머지 부분 사이의 연결을 약화시키기 때문에 마그네슘 착물의 형성은 ATP 가수분해 과정에서 중요한 요소이다.[2][4]
ATP의 가수분해에 의해 방출되는 에너지는 생물학적 표준 상태에서 ΔG -36.8 kJ mol−1로 커진다.
- ATP4− + H2O → ADP3− + Pi−
Pi는 생물학적 pH에서 양성자화된 무기 인산염을 나타낸다. 그러나 이는 무기물 기준으로는 크지 않다. "고에너지"라는 용어는 생물체에서 일어날 수 있는 생화학 반응에서 방출되는 에너지양에 비해 상대적으로 높다는 것을 의미한다.
고분자 무기 폴리인산염[편집]
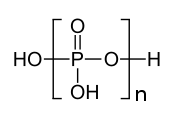
고분자량의 폴리인산염이 잘 알려져 있다.[5] 유도체 중 하나는 유리질(즉, 무정형)의 그레이엄 염이다. 결정질 고분자량 폴리인산염에는 쿠롤 염, 매드렐 염이 있다. 이들 화학종은 화학식이 [NaPO3]n[NaPO3(OH)]2이며, 여기서 n은 2,000까지 커질 수 있다. 구조면에서 이들 중합체는 PO3− 단량체로 구성되며 사슬은 양성자화된 인산염으로 종결된다.[6]
자연에서[편집]
고분자 무기 폴리인산염은 1890년에 L. 리버만(L. Liberman)에 의해 살아있는 생물에서 발견되었다. 이러한 화합물은 에너지가 풍부한 무수 인산 결합으로 연결된 오르토인산염의 수개~수백개의 잔기를 포함하고 있는 선형 중합체이다.
이전에는 "분자 화석" 또는 극한 조건에서 미생물의 생존에 제공되는 인 및 에너지원으로 간주되었다. 이들 화합물은 조절 역할을 하는 것으로 알려져 있으며 생물의 모든 계에서 생성되며 유전적 및 효소적 수준 모두에서 대사 교정 및 제어에 관여하는 것으로 알려져 있다. 폴리인산염은 세균의 기하급수적 성장 단계의 특징인 유전 프로그램을 정지 상태에서의 세포 생존 프로그램인 "느린 경로에서의 삶(a life in the slow lane)"으로 전환하는 데 직접적으로 관여한다. 이들은 다음과 같이 세균에서 일어나는 많은 조절 메커니즘에 관여한다.
- 이들은 고정 생장 단계 및 많은 스트레스 요인에 대한 조정에 관여하는 많은 유전자 그룹의 발현을 담당하는 RNA 중합효소의 소단위체인 rpoS의 유도에 관여한다.
- 이들은 세포의 운동성, 생물막 형성 및 독성에 중요하다.
- 폴리인산염과 엑소폴리포스파테이스는 세균 세포의 두 번째 메신저로 엄격한 반응 인자인 구아노신 5'-이인산 3'-이인산(ppGpp)의 수준 조절에 관여한다.
- 폴리인산염은 세포막을 가로지르는 통로의 형성에 관여한다. Ca2+와 함께 폴리인산염과 폴리-b-하이드록시뷰티르산염에 의해 형성되는 통로는 다양한 생물들에서 수송 과정에 관여한다.
- 미생물(원핵생물 및 하등 진핵생물)에서 폴리인산염의 중요한 기능은 인산염과 에너지 저장을 제공하여 변화하는 환경 조건에 대응할 수 있도록 하는 것이다. 폴리인산염은 동물 세포에 존재하며 발생, 세포 증식 및 세포 분화, 특히 뼈 조직 및 뇌에서 조절 과정에 관여한다는 많은 데이터들이 있다.
사람에서 폴리인산염은 혈액 응고에 중요한 역할을 하는 것으로 나타났다. 혈소판에 의해 생성 및 방출되며[7] 혈전 형성에 필수적인 혈액 응고 인자 XII를 활성화시킨다. 하게만 인자라고도 하는 혈액 응고 인자 XII는 피브린 형성을 개시하고 혈관 및 혈전증으로부터 염증 반응시 누출에 기여하는 전염증 매개체인 브래디키닌의 생성을 개시한다.[8][9] 세균 유래의 폴리인산염은 감염 중인 숙주의 면역 반응을 손상시키고 재조합 엑소폴리포스파테이스로 폴리인산염을 표적화하면 패혈증에 걸린 쥐의 생존률이 향상된다.[10] 무기 폴리인산염은 독성 중금속 양이온에 대한 효모 세포의 내성에 중요한 역할을 한다.[11]
식품 첨가물로 사용[편집]
폴리인산 나트륨(E452(i)), 폴리인산 칼륨(E452(ii)), 폴리인산 칼슘 나트륨(E452(iii)), 폴리인산 칼슘(E452(iv))은 식품 첨가물로 사용된다. 일반적으로 다른 인산염 공급원(음식에서 자연적으로 생성되는 것을 포함)으로 인한 것 외에 어떠한 잠재적인 건강 위험도 제기하지 않는 것으로 알려져 있다. 고인산혈증 뿐만 아니라 뼈와 심혈관계 질환에 대한 해로운 영향의 우려가 제기되었지만, 이는 인산염 공급원의 지나친 섭취에만 관련이 있는 것으로 보인다. 대체로 합리적인 선에서의 섭취(하루에 체중 1 kg당 인산염 최대 40 mg)는 건강에 위협적이지 않은 것으로 보인다.[12][13]
같이 보기[편집]
각주[편집]
- ↑ “The Phosphate Method For Producing Quality Drinking Water” (PDF). Carus Chemical Company. 2001. 2011년 4월 19일에 원본 문서 (PDF)에서 보존된 문서. 2011년 4월 20일에 확인함.
- ↑ 가 나 Storer A, Cornish-Bowden A (1976). “Concentration of MgATP2- and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions”. 《Biochem J》 159 (1): 1–5. doi:10.1042/bj1590001. PMC 1164030. PMID 11772.
- ↑ Wilson J, Chin A (1991). “Chelation of divalent cations by ATP, studied by titration calorimetry”. 《Anal Biochem》 193 (1): 16–9. doi:10.1016/0003-2697(91)90036-S. PMID 1645933.
- ↑ Garfinkel L, Altschuld R, Garfinkel D (1986). “Magnesium in cardiac energy metabolism”. 《J Mol Cell Cardiol》 18 (10): 1003–13. doi:10.1016/S0022-2828(86)80289-9. PMID 3537318.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). 《Chemistry of the Elements》 2판. Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann’s Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi 10.1002/14356007.a19_465.pub3
- ↑ Ruiz FA, Lea CR, Oldfield E, Docampo R (Oct 2004). “Human platelet dense granules contain polyphosphate and are similar to acidocalcisomes of bacteria and unicellular eukaryotes”. 《J Biol Chem》 279 (43): 44250–7. doi:10.1074/jbc.M406261200. PMID 15308650.
- ↑ Müller F, Mutch NJ, Schenk WA, Smith SA, Esterl L, Spronk HM, Schmidbauer S, Gahl WA, Morrissey JH, Renné T (Dec 2009). “Platelet polyphosphates are proinflammatory and procoagulant mediators in vivo”. 《Cell》 139 (6): 1143–56. doi:10.1016/j.cell.2009.11.001. PMC 2796262. PMID 20005807.
- ↑ “Newly discovered mechanism by which blood clots form”. 《physorg.com》. 2009년 12월 10일. 2009년 12월 13일에 확인함.
- ↑ Roewe J, Stavrides G, Strueve M, Sharma A, Marini F, Mann A, Smith SA, Kaya Z, Strobl B, Mueller M, Reinhardt C, Morrissey JH, Bosmann M (August 2020). “Bacterial polyphosphates interfere with the innate host defense to infection”. 《Nature Communications》 11 (1): 4035. Bibcode:2020NatCo..11.4035R. doi:10.1038/s41467-020-17639-x. PMC 7423913. PMID 32788578.
- ↑ Andreeva N, Ryazanova L, Dmitriev V, Kulakovskaya T, Kulaev I (Aug 2013). “Adaptation of Saccharomyces cerevisiae to toxic manganese concentration triggers changes in inorganic polyphosphates.”. 《FEMS Yeast Res》 13 (5): 463–470. doi:10.1111/1567-1364.12049. PMID 23663411.
- ↑ “EFSA Panel on Food Additives and Flavourings (FAF), Younes, M., Aquilina, G., Castle, L., Engel, K. H., Fowler, P., ... & Mennes, W. (2019). Re‐evaluation of phosphoric acid–phosphates–di‐, tri‐and polyphosphates (E 338–341, E 343, E 450–452) as food additives and the safety of proposed extension of use. EFSA Journal, 17(6), e05674.”. 2022년 1월 7일에 원본 문서에서 보존된 문서. 2022년 4월 28일에 확인함.
- ↑ Ritz, E., Hahn, K., Ketteler, M., Kuhlmann, M. K., & Mann, J. (2012). Phosphate additives in food—a health risk. Deutsches Ärzteblatt International, 109(4), 49.
외부 링크[편집]
- Pavlov E, Grimbly C, Diao CT, French RJ (September 2005). “A high-conductance mode of a poly-3-hydroxybutyrate/calcium/polyphosphate channel isolated from competent Escherichia coli cells”. 《FEBS Lett.》 579 (23): 5187–92. doi:10.1016/j.febslet.2005.08.032. PMID 16150446. S2CID 35616647.
- Kulaev I, Vagabov V, Kulakovskaya T (1999). “New aspects of inorganic polyphosphate metabolism and function”. 《J. Biosci. Bioeng.》 88 (2): 111–29. doi:10.1016/S1389-1723(99)80189-3. PMID 16232585.
- Kulaev I, Kulakovskaya T (2000). “Polyphosphate and phosphate pump”. 《Annu. Rev. Microbiol.》 54: 709–34. doi:10.1146/annurev.micro.54.1.709. PMID 11018142.