질산: 두 판 사이의 차이
내용 삭제됨 내용 추가됨
잔글 로봇이 더함: hr:Dušična kiselina |
편집 요약 없음 |
||
| 2번째 줄: | 2번째 줄: | ||
'''질산'''(窒酸, [[수소|H]][[질소|N]][[산소|O]]<sub>3</sub>)은 무색의 부식성과 발연성이 있는 대표적인 [[산 (화학)|강산]]이다. '''초산'''(硝酸)이라고도 한다. [[유기 화합물]]의 [[나이트로화]]에 쓰인다. 용액 내에 질산의 비율이 86%를 넘을 경우 '''발연질산'''(發煙窒酸)이라 부른다. |
'''질산'''(窒酸, [[수소|H]][[질소|N]][[산소|O]]<sub>3</sub>)은 무색의 부식성과 발연성이 있는 대표적인 [[산 (화학)|강산]]이다. '''초산'''(硝酸)이라고도 한다. [[유기 화합물]]의 [[나이트로화]]에 쓰인다. 용액 내에 질산의 비율이 86%를 넘을 경우 '''발연질산'''(發煙窒酸)이라 부른다. |
||
순수할 때에는 무색을 띠나, 햇볕을 쪼이면 서서히 분해되어 황갈색(NO<sub>2</sub>)이 되므로 갈색 병에 넣어 보관한다. |
|||
2HNO<sub>3</sub> + hv → 2NO<sub>2</sub>(g) + H<sub>2</sub>O + 1/2 O<sub>2</sub> |
|||
또한 금속과 반응하면 질산염을 형성한다. |
|||
M(금속) + HNO<sub>3</sub> → M + NO<sub>3</sub> + H<sub>2</sub>(g) : 세척용 |
|||
NO<sub>3</sub><sup>-</sup> + H<sup>+</sup> + 8e<sup>-</sup> → NH<sub>4</sub><sup>+</sup> + 3H<sub>2</sub>O : 감극제 |
|||
{{토막글|화학}} |
{{토막글|화학}} |
||
2010년 5월 24일 (월) 02:03 판
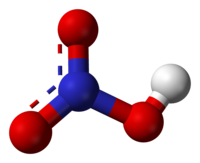
질산(窒酸, HNO3)은 무색의 부식성과 발연성이 있는 대표적인 강산이다. 초산(硝酸)이라고도 한다. 유기 화합물의 나이트로화에 쓰인다. 용액 내에 질산의 비율이 86%를 넘을 경우 발연질산(發煙窒酸)이라 부른다.
순수할 때에는 무색을 띠나, 햇볕을 쪼이면 서서히 분해되어 황갈색(NO2)이 되므로 갈색 병에 넣어 보관한다. 2HNO3 + hv → 2NO2(g) + H2O + 1/2 O2
또한 금속과 반응하면 질산염을 형성한다. M(금속) + HNO3 → M + NO3 + H2(g) : 세척용 NO3- + H+ + 8e- → NH4+ + 3H2O : 감극제
| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
