트라이글리세라이드
| 식품에 함유된 지방 |
|---|
| 같이 보기 |

트라이글리세라이드(영어: triglyceride, TG)는 1분자의 글리세롤에 3분자의 지방산이 에스터 결합을 통해 연결된 글리세라이드의 부류이다.[1] 트라이아실글리세롤(영어: triacylglycerol, TAG), 트라이아실글리세라이드(영어: triacylglyceride)라고도 한다. 트라이글리세라이드는 식물성 지방 뿐만 아니라 사람 및 다른 척추동물들의 체지방의 주요 구성 성분이다.[2] 트라이글리세라이드는 간에서 지방 조직의 세포 내에 존재하는 지방과 혈당 사이의 양방향 전달을 가능하게 하기 위해 혈액에 존재하며, 사람의 피지의 주요 구성 요소이다.[3]
많은 유형의 트라이글리세라이드들이 존재한다. 한 가지 특정 분류는 포화 및 불포화의 유형에 중점을 둔다. 포화 지방에는 탄소 원자와 탄소 원자 사이에 이중 결합(C=C)이 없다. 불포화 지방에는 탄소 원자와 탄소 원자 사이에 이중 결합(C=C)이 있다. 불포화 지방은 유사한 포화 지방보다 녹는점이 낮은 경향이 있는데, 이로 인해 실온에서 액체인 경우가 많다.
화학 구조[편집]

트라이글리세라이드는 글리세롤에 3개의 지방산 분자가 결합된 트라이에스터이다. 알코올에는 하이드록실기(–OH)가 있다. 유기산에는 카복실기(–COOH)가 있다. 알코올의 하이드록실기와 유기산의 카복실기는 결합하여 에스터를 형성한다. 글리세롤은 3개의 하이드록실기를 가지고 있고, 각각의 지방산은 카복실기를 가지고 있다. 트라이글리세라이드에서 글리세롤의 하이드록실기는 지방산의 카복실기와 결합하여 에스터 결합을 형성한다.
- HOCH2CH(OH)CH2OH + RCO2H + R′CO2H + R″CO2H → RCO2CH2CH(O2CR′)CH2CO2R″ + 3H2O
세 가지 지방산(위의 식에서 RCO2H, R′CO2H, R″CO2H)들은 일반적으로 서로 다르기 때문에 다양한 종류의 트라이글리세라이드들이 알려져 있다. 자연적으로 생성되는 트라이글리세라이드에서 지방산의 사슬의 길이는 다양하지만 대부분은 16개, 18개, 20개의 탄소 원자들로 구성되어 있다. 식물과 동물에서 발견되는 천연 지방산은 일반적으로 짝수 개의 탄소 원자들로 구성되어 있으며, 이는 2탄소 빌딩 블록인 아세틸-CoA로부터 생합성된 경로를 반영하는 것이다. 그러나 세균은 홀수 지방산 및 가지사슬 지방산을 합성하는 능력을 가지고 있다. 그 결과 반추동물의 동물성 지방에는 반추위에서 공생하고 있는 세균의 작용으로 15개의 탄소로 이루어진 지방산과 같은 홀수 지방산이 포함되어 있다. 많은 지방산들이 불포화되어 있다. 이중 일부는 다불포화(예: 리놀레산으로부터 파생됨)되어 있다.[4]
대부분의 천연 지방에는 개별 트라이글리세라이드의 복잡한 혼합물들이 포함되어 있다. 이 때문에 녹는점의 범위가 넓다. 코코아 버터는 각각 글리세롤의 1번, 2번, 3번 위치에 팔미트산, 올레산, 스테아르산이 결합되어 있고, 이로부터 파생된 몇몇 트라이글리세라이드들로 구성되어 있다는 점에서 특이하다.[4]
호모트라이글리세라이드 및 헤테로트라이글리세라이드[편집]
가장 단순한 트라이글리세라이드는 3개의 지방산이 동일한 트라이글리세라이드이다. 이들의 이름은 지방산을 나타내는 데 스테아르산으로부터 파생된 스테아린, 팔미트산으로부터 파생된 팔미틴 등이 있다. 이 화합물은 세 가지 결정형태(다형성)로 얻을 수 있는데, α, β, β′의 세 가지 형태는 녹는점이 다르다.[4][5]
글리세롤의 첫 번째와 세 번째 지방산이 다르면 트라이글리세라이드는 카이랄성이다.[6]
입체형태[편집]
지방과 지방산 분자의 형태는 일반적으로 잘 정의되어 있지 않다. 하나의 단일 결합으로 연결된 분자의 두 부분은 해당 결합을 중심으로 자유롭게 회전한다. 따라서 n개의 단일 결합을 가지고 있는 지방산 분자는 n-1개의 독립적인 방식으로 변형(말단 메틸기의 회전도 계산)될 수 있다.
이러한 회전은 이중 결합에서는 일어날 수 없으며, 분자의 반쪽 중 하난가 180도 회전하여 끊어졌다가 다시 형성되는 경우를 제외하고는 상당한 에너지 장벽을 넘어야 한다. 따라서 이중 결합을 가지고 있는 지방 또는 지방산 분자(사슬을 맨 끝 부분은 제외)는 화학적 특성 및 생물학적 특성이 크게 다른 여러 시스-트랜스 이성질체를 가질 수 있다. 각각의 이중 결합은 입체형태적 자유도를 하나씩 줄인다. 각각의 삼중 결합은 가장 가까운 4개의 탄소를 직선으로 놓이도록 하여 2개의 자유도를 제거한다.
이중 결합이 없는(예: 스테아르산) "곧게 뻗은 지그재그" 형태의 포화 지방산과 "팔꿈치" 형태로 구부러진 하나의 시스 결합(예: 올레산)이 있는 불포화 지방산의 묘사에는 다소 오해의 소지가 있다. 단일불호화 지방산은 약간 덜 유연하지만, 포화 지방산과 단일불포화 지방산 둘 다 비슷한 직선 또는 팔꿈치 형태를 취하도록 비틀 수 있다. 사실 결정이나 지질 이중층과 같은 특정 상황을 제외하면 둘 다 이 두 형태 중 하나보다 무작위로 뒤틀린 입체배치로 발견될 가능성이 더 크다.
예[편집]
| 스테아르산 포화 지방산 |
|
|---|---|
| 올레산 불포화 지방산 시스-8 |

|
| 엘라이드산 불포화 지방산 트랜스-8 |
|
| 박센산 불포화 지방산 트랜스-11 |
스테아르산은 동물성 지방에서 발견되는 포화 지방산(단일 결합으로만 구성)이며, 완전 수소화에서 의도되는 생성물이다.
올레산은 사슬의 중간쯤에 시스 가하 특성을 지닌 이중 결합(불포화됨)을 가지고 있는데, 올리브 기름의 55~80%를 차지한다.
엘라이드산은 올레산의 트랜스 이성질체이다. 엘라이드산은 부분적으로 수소화된 식물성 기름에 존재할 수 있으며 두리안의 지방(약 2%)과 유지방(0.1% 미만)에도 존재한다.
박센산은 이중 결합의 위치만 엘라이드산과 다른 또 다른 트랜스 이성질체이며, 유지방(약 1~2%)에도 존재한다.
명명법[편집]
지방의 일반적 명칭[편집]
지방은 일반적으로 공급원의 이름을 따서 명명(예: 올리브유, 대구간유, 시어버터, 양꼬리지방) 또는 고유의 관용명(예: 버터, 라드, 기, 마가린)을 갖는다. 이러한 이름들 중 일부는 적절한 지방 외에 상당한 양의 다른 구성 성분들을 포함하는 제품을 나타낸다.
지방산의 화학적 명칭[편집]
화학 및 생화학에서 수십 개의 포화 지방산과 수백 개의 불포화 지방산들은 일반적으로 그들의 원천 지방에서 유래한 전통적인 과학명(예: 뷰티르산, 카프릴산, 스테아르산, 올레산, 팔미트산, 네르본산)을 갖지만 때로는 발견자의 이름을 따서(예: 미드산, 오스본드산) 명명된 경우도 있다.
트라이글리세라이드는 "글리세릴 1,2-다이올레에이트 3-팔미테이트"와 같이 지방산의 에스터로 명명된다.[7]
국제 순수·응용 화학 연합 (IUPAC)[편집]
국제 순수·응용 화학 연합(IUPAC)에서 만든 일반적인 화학 명명법에서 해당하는 탄화수소의 이름으로부터 파생된 지방산의 권장명은 탄소수와 이중 결합의 수와 위치를 지정하여 지방산의 구조를 완전히 설명한다. 예를 들어 올레산은 "(9Z)-옥타덱-9-엔산((9Z)-octadec-9-enoic acid)"이라고 하며, 이는 한 쪽 끝에 카복실기("oic")가 있고 카복실기로부터 9번째 탄소에 이중 결합이 하나가 있는("9-en") 18개의 탄소로 이루어진 사슬("octadec")을 가지고 있고 이중 결합에 인접한 단일 결합의 입체배치는 시스("(92)")임을 의미한다. IUPAC 명명법은 또한 수소 원자가 다른 화학 작용기로 치환되는 분지 사슬 및 유도체들에 대해서도 기술할 수 있다.
트라이글리세라이드는 예를 들어 "프로페인-1,2,3-티릴 1,2-비스((9Z)-옥타덱-9-에노에이트) 3-(헥사데카노에이트)"와 같은 일반적인 에스터 명명 규칙에 따라 명명된다.
지방산 코드[편집]
IUPAC만큼 정확하지만 구문 분석이 더 쉬운 가지사슬이 없는 지방산에 대한 표기법은 "{N}:{D} 시스-{CCC} 트랜스-{TTT}" 형식의 코드이다. 여기서 {N}은 탄소수(카복실기의 탄소 포함), {D}는 이중 결합의 수, {CCC}는 시스 이중 결합의 위치 목록, {TTT}는 트랜스 이중 결합의 위치 목록이다. 해당 유형의 결합이 없는 경우 목록과 라벨이 생략된다.
해당하는 지방산 코드, 예를 들어 스테아르산은 "18:0", 올레산은 "18:1 시스-9", 엘라이드산은 "18:1 트랜스-9", 박센산은 "18:1 트랜스-11"로 표기된다. IUPAC 명명법에서 "(9E,11E,13Z)-옥타데카-9,11,13-트라이엔산"인 α-올레오스테아르산의 코드는 "18:3 트랜스-9,11 시스-13"이다.
분류[편집]
사슬의 길이[편집]
지방은 구성하는 지방산의 탄소 사슬의 길이에 따라 분류할 수 있다. 녹는점 및 산성도와 같은 대부분의 화학적 특성은 이 매개 변수에 따라 점진적으로 변하기 때문에 급격한 구분이 없다. 화학적으로 폼산(탄소 1개)와 아세트산(탄소 2개)은 가장 짧은 지방산으로 볼 수도 있다. 그러면 트라이폼인이 가장 단순한 트라이글리세라이드가 될 것이다. 그러나 일반적으로 "지방산" 및 "지방"이라는 용어는 실질적으로 더 긴 탄소 사슬을 가지고 있는 화합물에 사용된다.
생화학 및 영양학에서 일반적으로 분류되는 부문은 다음과 같다.
- 짧은사슬 지방산(SCFA)은 탄소수가 6개 미만이다(예: 뷰티르산).
- 중간사슬 지방산(MCFA)은 탄소수가 6~12개이다(예: 카프르산).
- 긴사슬 지방산(LCFA)은 탄소수가 13~21개이다(예: 페트로셀린산).
- 매우 긴사슬 지방산(VLCFA)은 탄소수가 22개 이상이다(예: 세로트산은 탄소수가 26개임).
트라이글리세라이드 분자는 길이가 다른 지방산을 가질 수 있으며, 지방은 보통 다양한 트라이글리세라이드들의 혼합물이다. 식물성이든 동물성이든 음식에서 발견되는 대부분의 지방은 보통 길이가 같거나 거의 같은 중간사슬 지방산 내지 긴사슬 지방산으로 구성된다.
포화 지방 및 불포화 지방[편집]
사람의 영양에서 지방의 중요한 분류는 구성하고 있는 지방산들의 이중 결합의 수와 위치를 기반으로 한다. 포화 지방은 이중 결합이 없는 포화 지방산이 우세한 반면, 불포화 지방은 이중 결합이 있는 불포화 지방산이 우세하다. 각각의 이중 결합은 화학식에서 두 개의 적은 수소 원자를 가지고 있음을 나타낸다. 따라서 이중 결합이 없는 포화 지방산은 주어진 탄소 원자 수에 대해 최대 수소 원자 수를 갖는다. 즉, 수소 원자로 포화된다.[8][9]
불포화 지방산은 한 개의 이중 결합을 가진 단일불포화 지방산(MUFA)과 2개 이상의 이중 결합을 가진 다불포화 지방산(PUFA)으로 나눌 수 있다.[8][9] 천연 지방은 일반적으로 동일한 분자 내에서도 여러가지 다른 포화 지방산 및 불포화 지방산을 포함하고 있다. 예를 들어 대부분의 식물성 기름에서 포화 지방산인 팔미트산(C16:0)과 스테아르산(C18:0) 잔기는 일반적으로 글리세롤의 1번 위치 및 3번 위치(sn1 및 sn3)에 부착되는 반면 중간 위치 (sn2)에는 일반적으로 올레산(C18:1, ω–9) 또는 리놀레산(C18:2, ω–6)과 같은 불포화 지방산이 부착된다.[10]
| 스테아르산 (포화, C18:0) | |
| 팔미톨레산 (단일불포화, C16:1 시스-9, 오메가-7) | |
| 올레산 (단일불포화, C18:1 시스-9, 오메가-9) | |
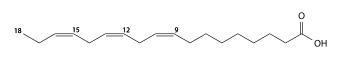 |
α-리놀렌산 (다불포화, C18:3 시스-9,12,15, 오메가-3) |
 |
γ-리놀렌산 (다불포화, C18:3 시스-6,9,12, 오메가-6) |
일반적으로 가장 큰 관심을 받는 것은 다불포화 지방산의 영양적 측면이지만, 이들 물질은 식품 이외의 용도로도 사용된다. 여기에는 아마인유, 동유, 양귀비씨 기름, 들기름, 호두기름과 같은 건성유가 포함되며, 산소에 노출되면 중합되어 고체 필름을 형성하고 페인트 및 바니시를 만드는 데 사용된다.
포화 지방은 일반적으로 같은 분자량의 불포화 지방보다 녹는점이 높기 때문에 실온에서 고체 상태인 경우가 많다. 예를 들어 동물성 지방인 탤로와 라드는 포화 지방산 함량이 높고, 고체이다. 반면에 올리브유와 아마인유는 불포화되어 있고, 액체이다. 불포화 지방은 공기에 의해 산화되기 쉬워서 산패되어 먹을 수 없게 된다.
불포화 지방의 이중 결합은 촉매에 의해 영향을 받는 수소와의 반응에 의해 단일 결합으로 전환될 수 있다. 수소화라고 불리는 이러한 과정은 식물성 기름을 마가린과 같은 고체 또는 반고체 식물성 지방으로 바꾸는 데 사용되며, 이는 탤로와 버터를 대체할 수 있으며, 불포화 지방과 달리 산패되지 않고 무기한 저장할 수 있다. 그러나 부분 수소화는 시스 지방산으로부터 원치 않는 일부 트랜스 지방산을 생성한다.[11]
세포의 물질대사에서 불포화 지방 분자는 동등한 양의 포화 지방보다 약간 적은 에너지(즉, 더 적은 칼로리)를 생성한다. 18개의 탄소를 가지고 있는 포화 지방산 에스터, 모노불포화 지방산 에스터, 다이불포화 지방산 에스터, 트라이불포화 지방산 에스터의 연소열은 각각 2859 kcal/mol, 2828 kcal/mol, 2794 kcal/mol, 2750 kcal/mol로 측정되었다. 중량 기준으로는 각각 10.75 kcal/g, 10.71 kcal/g, 10.66 kcal/g, 10.58 kcal/g이며, 각각 추가적인 이중 결합에 대해 약 0.6% 감소하였다.[12]
지방산의 불포화도가 높을수록(즉, 지방산의 이중 결합이 많을수록) 지질 과산화(산패)에 대 취약하다. 항산화제는 지질 과산화로부터 불포화 지방을 보호할 수 있다.
시스 지방 및 트랜스 지방[편집]
불포화 지방산의 또 다른 중요한 분류는 이중 결합에 인접한 C–C 단일 결합의 공간적 배열인 시스-트랜스 이성질체를 고려하는 것이다. 자연에서 생성되는 대부분의 불포화 지방산은 시스 입체배치의 결합을 가지고 있다. 시스 지방의 부분 수소화는 지방산의 일부를 트랜스 입체배치로 변환시킬 수 있다.
엘라이드산은 사람의 식단에서 가장 흔한 지방산 중 하나인 올레산의 트랜스 이성질체이다. 하나의 이중 결합에서 입체배치의 변화로 인해 서로 다른 화학적 특성 및 물리적 특성이 나타난다. 엘라이드산의 녹는점은 45 °C로 올레산의 녹는점인 13.4 °C보다 훨씬 더 높다. 이러한 차이는 일반적으로 트랜스 분자가 더 빽빽하게 밀집되어 보다 더 견고한 고체를 형성할 수 있는 능력에 기인한다.[13]
오메가 넘버[편집]
또 다른 분류는 사슬 말단(카복실기의 반대편)으로부터의 이중 결합의 위치를 고려한다. 위치는 "ω−k" 또는 "n−k"로 표시되며, 이는 탄소 k와 k+1 사이에 이중 결합이 있음을 의미하며, 이는 말단에서부터 세어진다. 예를 들어 α-리놀렌산은 "ω−3" 또는 "n−3" 지방산이며 이는 말단에서부터 3번째와 4번째 탄소 사이에 이중 결합이 있음을 의미하며, 구조식은 –CH=CH–CH
2–CH
3로 끝난다.[14]
포화 지방산의 예[편집]
포화 지방산의 몇 가지 예는 다음과 같다.
- 뷰티르산 – 탄소수가 4개인 포화 지방산 (버터에 함유)
- 라우르산 – 탄소수가 12개인 포화 지방산 (코코넛유, 팜핵유, 모유에 함유)
- 미리스트산 – 탄소수가 14개인 포화 지방산 (우유 및 유제품에 함유)
- 팔미트산 – 탄소수가 16개인 포화 지방산 (야자유와 육류에 함유)
- 스테아르산 – 탄소수가 18개인 포화 지방산 (육류 및 코코아 버터에 함유)
불포화 지방산의 예[편집]
- 미리스톨레산 – C14:1, ω−5, 시스-9-테트라데센산
- 사피엔산 – C16:1 ω−10, 시스-6-헥사데센산
- 팔미톨레산 – C16:1, ω−7 , 시스-9-헥사데센산
- 올레산 – C18:1 ω−9, 시스-9-옥타데센산
- 페트로셀린산 – C18:1 ω−12, 시스-옥타덱-6-엔산
- 시스-박센산 – C18:1 ω−7) 시스-11-옥타데센산
- 박센산 – C18:1 ω−7, 트랜스-11-옥타데센산
- 엘라이드산 – 18:1 ω−9, 트랜스-9-옥타데센산 (트랜스-올레산)
- 리놀레산
- 리놀렌산
- 파울린산 – C20:1 ω−7, 시스-13-에이코센산
- 가돌레산 – C20:1 ω−11, 시스-9-에이코센산
- 곤도산 – 20:1 ω−9, 시스-11-에이코센산
- 에루크산 – C22:1 ω−9, 시스-15-도코센산
- 브라시드산 – C22:1 ω−9, 트랜스-15-도코센산
- 네르본산 – C24:1 ω−9, 시스-15-테트라코센산
- 아라키돈산
산업용[편집]
아마인유 및 관련 기름들은 유성 페인트 및 관련 코팅에 사용되는 제품들의 중요 구성 성분이다. 아마인유는 다이불포화 지방산 및 트라이불포화 지방산이 풍부하여 산소가 있으면 경화되는 경향이 있다. 이러한 열을 발생시키는 경화 과정은 건성유 특유의 것이다. 이것은 탄소 골격을 공격하는 산소 분자로 시작하는 중합 과정에 의해 발생한다.
트라이글리세라이드는 또한 바이오디젤을 제조하는 동안 에스터교환 반응을 통해 구성 요소로 분할된다. 생성된 지방산 에스터는 디젤 엔진의 연료로 사용될 수 있다. 글리세린은 식품 제조 및 의약품 생산과 같이 다양한 용도로 사용한데용.
염색[편집]
지방산, 트라이글리세라이드, 지질단백질 및 기타 지질에 대한 염색은 리소크롬(지용성 염료)를 사용하여 수행된다. 이러한 염료는 물질을 특정 색상으로 염색함으로써 관심있는 특정 지방을 선별할 수 있게 한다. 예로는 수단 IV, 오일 레드 O, 솔벤트 블랙 3가 있다.
같이 보기[편집]
- 글리세라이드
- 모노글리세라이드
- 다이글리세라이드
- 다이글리세라이드 아실기전이효소 – 중성지방 생합성을 담당하는 효소
- 중간사슬 트라이글리세라이드
- 지질 프로필
- 지질
- 수직 자동 프로필
각주[편집]
- ↑ “Nomenclature of Lipids”. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). 2007년 3월 8일에 확인함.
- ↑ Nelson, D. L.; Cox, M. M. (2000). 《Lehninger, Principles of Biochemistry》 3판. New York: Worth Publishing. ISBN 1-57259-153-6.
- ↑ Lampe, M. A.; Burlingame, A. L.; Whitney, J.; Williams, M. L.; Brown, B. E.; Roitman, E.; Elias, M. (1983). “Human stratum corneum lipids: characterization and regional variations”. 《J. Lipid Res.》 24 (2): 120–130. doi:10.1016/S0022-2275(20)38005-6. PMID 6833889.
- ↑ 가 나 다 Alfred Thomas (2002). 〈Fats and Fatty Oils〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_173. ISBN 3527306730.
- ↑ Charbonnet, G. H.; Singleton, W. S. (1947). “Thermal properties of fats and oils”. 《J. Am. Oil Chem. Soc.》 24 (5): 140. doi:10.1007/BF02643296. S2CID 101805872.
- ↑ Lok, C.M.; Ward, J.P.; van Dorp, D.A. (1976). “The synthesis of Chiral Glycerides starting from D- and L-serine”. 《Chemistry and Physics of Lipids》 16 (2): 115–122. doi:10.1016/0009-3084(76)90003-7. PMID 1269065.
- ↑ N. Koeniger and H. J. Veith (1983): "Glyceryl-1,2-dioleate-3-palmitate, a brood pheromone of the honey bee (Apis mellifera L.)". Experientia, volume 39, pages 1051–1052 doi 10.1007/BF01989801
- ↑ 가 나 “Essential Fatty Acids”. Micronutrient Information Center, Oregon State University, Corvallis, OR. May 2014. 2017년 5월 24일에 확인함.
- ↑ 가 나 “Omega-3 fatty acids, fish oil, alpha-linolenic acid”. Mayo Clinic. 2017. 2017년 5월 24일에 확인함.
- ↑ Institute of Shortenings and Edible oils (2006). “Food Fats and oils” (PDF). 2007년 3월 26일에 원본 문서 (PDF)에서 보존된 문서. 2009년 2월 19일에 확인함.
- ↑ Marchand, V (2010). “Trans fats: What physicians should know”. 《Canadian Paediatric Society》 6 (15): 373–375. doi:10.1093/pch/15.6.373. PMC 2921725. PMID 21731420.
- ↑ Krisnangkura, Kanit (1991). “Estimation of heat of combustion of triglycerides and fatty acid methyl esters”. 《Journal of the American Oil Chemists' Society》 68: 56–58. doi:10.1007/BF02660311. S2CID 84433984.
- ↑ 〈Section 7: Biochemistry〉. 《Handbook of chemistry and physics》. 2007–2008 88판. Taylor and Francis. 2007. 2017년 7월 24일에 원본 문서 (PDF)에서 보존된 문서. 2007년 11월 19일에 확인함.
- ↑ Karen Dooley (2008): "Omega-three fatty acids and diabetes". Online article at the University of Florida's UFHealt website. Accessed on 2020-08-30.
외부 링크[편집]
- Lowering Triglycerides (EMedicineHealth.com; October 2020)