키네이스

키네이스(Kinase, 키나아제), 또는 인산화효소(燐酸化酵素) 또는 활성효소는 ATP와 같은 고에너지 주개 분자의 인산기를 특정한 기질에 전달하는 인산화반응을 촉매하는 효소이다. 인산화효소는 인산전달효소(phosphotransferase)족의 한 부분이다. 인산화효소는 무기 인산기를 받개에 부가하는 반응을 매개하는 가인산분해효소(phosphorylase)나, 인산기를 제거하는 반응을 매개하는 인산가수분해효소(phosphatase)와 구분하여야 한다. 단백질, 지질 또는 탄수화물은 인산화 상태에 따라 활성, 반응성, 다른 분자와 결합할 수 있는 능력 등이 변화한다. 따라서 인산화효소는 물질대사, 세포간 신호전달(cell signaling), 단백질 조절(protein regulation), 세포 수송, 분비 및 그 밖에 수많은 세포반응경로에 매우 중요한 역할을 한다.
역사 및 분류[편집]
1954년 진 케네디(Gene Kennedy)가 카제인(casein)을 인산화하는 간 효소를 발견하였다. 이 효소가 ATP를 이용하여 다른 단백질을 인산화하는 반응을 촉매하는 효소로서 최초로 기록된 것이다. 1956년에 에드먼드 피셔(Edmond H. Fischer)와 에드윈 크레브스(Edwin G. Krebs)는 가인산분해효소 a와 가인산분해효소 b 사이의 상호 변환이 인산화와 탈인산화에 의해 매개된다는 것을 발견하였다.[2] 가인산분해효소 b로 인산기를 전달하여 가인산분해효소 a로 전환하는 인산화효소는 가인산분해효소 인산화효소로 명명되었다. 몇 년 후에 인산화효소를 통한 신호전달경로의 첫 예시로서 단백질 인산화효소 A(PKA)가 가인산분해효소 인산화효소를 인산화한다는 사실이 밝혀졌다. 또한 PKA가 글리코겐 합성효소(glycogen synthase)를 저해한다는 것이 알려졌으며, 이는 인산화를 통하여 저해 작용을 하는 최초의 예시이다. 1969년에 레스터 리드(Lester Reed)는 피루브산 탈수소효소가 인산화되어 불활성화된다는 것을 밝혀내어, 인산화가 글리코겐 대사뿐만 아니라 다른 대사 경로에도 조절 작용을 한다는 단서를 제공하였다.[3] 같은 해에 톰 랭건(Tom Langan)은 PKA가 히스톤 H1을 인산화하며, 효소가 아닌 단백질도 인산화를 통해 조절된다고 제기하였다.[4] 1970년대에 칼모듈린 의존성 단백질 인산화효소가 발견되었으며, 단백질은 하나의 아미노산 잔기 이상으로 인산화될 수 있음이 알려졌다. 1990년대에 들어서 MAPK/ERK 경로, JAK 인산화효소(티로신 인산화효소족), 그리고 PIP3 의존성 인산화효소 신호전달경로 등이 계속해서 밝혀졌다.
인산화효소는 기질에 따라 단백질 인산화효소, 지질 인산화효소, 탄수화물 인산화효소 등 다양한 그룹으로 나뉜다. 인산화효소는 박테리아에서 곰팡이, 곤충, 포유류에 이르기까지 다양한 종에서 발견된다.[5] 인간에게서는 500개 이상의 인산화효소가 발견되었다.[6] 단백질 인산화효소는 종종 다수의 기질을 가지기도 하고, 때때로 단백질이 하나 이상의 인산화효소에 기질로 작용한다. 때문에 단백질 인산화효소는 스스로의 활성을 조절하는 인자를 이용하여 명명한다. 예를 들어 칼모듈린 의존성 단백질 인산화효소는 칼모듈린의 조절을 받는다. 때때로 그들은 하부 그룹으로 나뉘는데 이는 동위효소의 존재 때문이다. 예를 들어 제 1형 및 제 2형 고리형 AMP(cAMP)에 의존하는 단백질 인산화효소(PKA)는 동일한 효소 소단위로 구성되지만 다른 조절 소단위가 고리형 AMP에 결합하여 조절된다.[7]
생화학적 기능[편집]
인산화효소는 고에너지분자, 예를 들어 ATP와 같은 분자의 인산 작용기를 기질 분자로 옮기는 반응을 매개한다. 이 반응에는 고에너지를 가지는 인산무수결합이 관여하기 때문에 인산화효소는 인산무수결합을 안정화하는 역할을 한다. 인산화효소는 기질과 인산기를 활성 자리에 적절하게 배열하여 반응 속도를 높인다. 음전하를 띤 인산기와 상호작용하여 나타나는 전이상태는 대부분의 경우 양전하를 띤 아미노산을 통해 정전기적으로 안정화된다. 몇몇 인산화효소는 금속 보조인자를 이용하여 인산기와 배위결합한다.
인산화효소는 세포내 신호전달(signal transduction)에 광범위한 영향을 미치고 세포 내부의 복잡한 기작들을 조절한다. 어떤 분자는 인산화를 통하여 활성이 강화되거나 저해되며, 다른 분자와 상호작용하는 능력이 조절된다. 많은 인산화효소가 환경 조건이나 신호에 따라 반응하기 때문에 세포는 상황에 따라 세포 내의 분자를 통제할 수 있다. 인산화효소에 기능을 상실하는 돌연변이나 기능을 얻는 돌연변이가 발생하면 암[8] 이나 기타 질병을 유발한다. 사람에게는 특정 종류의 백혈병과 신경종(neuroblastoma), 척수소뇌성 운동실조(spinocerebellar ataxia type 14), 무감마글로불린혈증(agammaglobulinaemia) 등[9] 이 포함된다.

단백질 인산화효소[편집]

단백질 인산화효소(Protein kinase)는 단백질의 세린, 트레오닌, 타이로신, 히스티딘 잔기를 인산화한다. 인산화를 통하여 단백질의 기능은 다방면으로 변화한다. 단백질의 활성을 증가시키거나 감소시키고, 안정화하거나 분해를 위한 표식이 되기도 하며, 특정한 세포 구획에 위치시키기도 하고, 다른 단백질과의 상호작용을 개시하거나 교란할 수 있다. 단백질 인산화효소는 인산화효소의 대부분을 차지하며 널리 연구의 대상이 된다.[6] 단백질 인산화효소는 인산분해효소와 함께 세포 신호전달뿐만 아니라 단백질 및 효소 조절 역할을 한다.
세포 단백질은 수많은 공유결합의 대상이지만 인산화반응처럼 가역적인 공유결합은 많지 않다. 이로 인하여 단백질의 인산화가 조절적 기능을 갖는 것이다. 다른 자리 입체성 조절 이외에도 단백질과 공유결합할 수 있는 방법이 많으므로 단백질 기능을 조절할 수 있는 가능성은 무궁무진하다. 에드윈 크레브스는 홉킨스 회고 강연에서 다른 자리 입체성 조절은 세포 내부에서 일어나는 신호에 반응하기 위하여 일어나는 반면, 인산화는 세포 외부로부터의 신호에 대해 일어나도록 진화하였다고 주장하였다. 원핵생물에 비하여 진핵생물은 폭넓은 신호에 반응하도록 진화한 복잡한 세포이기 때문에, 이 주장은 단백질 인산화가 진핵생물에서 더 빈번하게 일어난다는 것과 일치한다.[7]
사이클린 의존성 인산화효소[편집]
사이클린 의존성 인산화효소(Cyclin-dependent Kinase; CDKs)는 세포주기 조절과 관련된 인산화효소들이다. 다른 단백질의 세린 혹은 트레오닌 잔기를 인산화하지만, 반드시 사이클린 단백질과 먼저 결합하여야 활성을 보인다.[10] 세포주기는 특정한 CDK와 사이클린의 조합에 따라 진행된다. CDK는 인산화 상태에 따라 활성이 달라지므로 다른 인산화효소(e.g. CDK 활성화 인산화효소)와 인산분해효소(e.g. Cdc25)의 조절을 받는다.[11] CDK가 활성화되면 다른 단백질을 인산화하여 활성을 조절하여 세포주기의 다음 단계에 필수적인 변화를 일으킨다. CDK는 주로 세포주기를 조절하는 역할로 알려져 있지만, 전사, 대사, 그리고 세포에서 일어나는 다른 일들에도 관여한다.[12] CDK는 세포분열을 조절하는 데에 중요한 역할을 하므로 암세포에서는 흔히 CDK에 돌연변이가 발견된다. 돌연변이로 인하여 세포는 세포주기를 반복해서 빠르게 진행하고 무분별하게 증식한다.[13] CDK 돌연변이는 림프종, 유방암, 췌장암, 폐암에서 발견된다. 몇몇 종류의 암에 대해 CDK 저해제를 이용한 치료법이 개발되었다.[13]
유사분열 활성화 단백질 인산화효소[편집]
유사분열 활성화 단백질 인산화효소(Mitogen-Activated Protein Kinases; MAP kinase; MAPKs)는 세린/트레오닌 인산화효소족으로 다양한 세포외 성장 신호에 반응한다. 성장 호르몬이나 상피성장인자, 혈소판 유래 성장인자, 인슐린은 모두 유사분열 자극으로 MAPK 경로와 연계된다. 수용체 수준에서 MAPK 경로가 활성화되면 신호전달 연쇄반응이 개시되고 Ras GTPase는 GDP를 GTP로 교환한다. 이어서 Ras는 Raf 인산화효소(MAPKKK)를, Raf 인산화효소는 유사분열 활성화 단백질 인산화효소 인산화효소(Mitogen-activated Protein Kinase Kinase; MAPKK; MEK)를, MEK는 MAPK(ERK)를 활성화한다. MAPK는 이어서 전사와 번역을 조절한다. Raf와 MAPK가 세린/트레오닌 인산화효소인데 반하여 MAPKK는 타이로신/트레오닌 인산화효소이다.

MAPK는 전사인자를 직·간접적으로 조절한다. 주요 전사 표적은 ATF-2, Chop, c-Jun, c-Myc, DPC4, Elk-1, Ets1, Max, MEF2C, NFAT4, Sap1a, STATs, Tal, p53, CREB, 그리고 Myc를 포함한다. 또한 리보솜 대단위체의 S6 인산화효소를 인산화하여 번역을 조절한다. MAPK 연쇄반응의 초기 경로를 이루는 Ras, Sos, 상피성장인자 수용체(EGF receptor) 자체도 인산화 할 수 있다.[14]
MAPK 경로는 임상적으로 주목을 받고 있다. MAPK 경로가 관여하는 세포 기작은 세포성장을 통제하기 때문에 MAPK 경로에 돌연변이가 생기면 세포분화, 증식, 생존, 세포자살(apoptosis)에 대한 조절 작용이 변질되고 따라서 종양이 생성될 수 있다.[14]
지질 인산화효소[편집]
지질 인산화효소(Lipid kinases)는 원형질막 뿐만 아니라 세포소기관 막에 있는 지질을 인산화한다. 인산기의 부가로 지질의 반응성과 위치가 달라지고 신호 전달에 이용될 수 있다.
포스파티딜이노시톨 인산화효소[편집]
포스파티딜이노시톨 인산화효소(Phosphatidylinositol kinases)는 포스파티딜이노시톨(phosphatidylinositol)을 인산화하여 포스파티딜이노시톨 3,4-이인산(phosphatidylinositol 3,4-bisphosphate, PI(3,4)P2), 포스파티딜이노시톨 3,4,5-삼인산(phosphatidylinositol 3,4,5-trisphosphate, PIP3), 그리고 포스파티딜이노시톨 3-인산(phosphatidylinositol 3-phosphate, PI3P) 등을 만든다. 포스파티딜이노시톨 인산화효소의 예로는 포스포이노시티드 3-인산화효소(phosphoinositide 3-kinase, PI3K), 포스포파티딜이노시톨-4-인산 3-인산화효소(phosphatidylinositol-4-phosphate 3-kinase, 그리고 포스파티딜이노시톨-4,5-이인산 3-인산화효소(phosphatidylinositol-4,5-bisphosphate 3-kinase)가 있다. 포스파티딜이노시톨의 인산화 상태는 인슐린 신호전달경로와 같은 세포신호전달에 중요한 역할을 하고, 세포내이입(endocytosis), 세포외유출(exocytosis 및 기타 수송에도 역할을 한다.[15][16] PI3K와 같은 포스파티딜이노시톨 인산화효소에 돌연변이가 생기면 암이나 인슐린 저항성을 유발할 수 있다.[17]

인산화효소는 이노시톨 수산화기를 더 친핵성을 띠게 하여 반응 속도를 증가시키는데, 종종 아래 기작과 같이 아미노산 잔기의 곁사슬을 일반 염기로 작용하게 하여 수산화기에서 수소를 제거한다.[18] 효소는 또한 이노시톨기뿐만 아니라 ATP 분자가 적절하게 자리를 잡도록 도와 반응이 더 빨리 일어나도록 한다. 금속 이온이 배위결합하여 반응을 돕기도 한다.[18]

스핑고신 인산화효소[편집]
스핑고신 인산화효소(Sphingosine kinase)은 스핑고신을 스핑고신-1-인산(sphingosine-1-phosphate, S1P)으로 전환하는 효소이다. 스핑고지질은 막에 널리 존재하는 막지질이다. 스핑고신 인산화효소가 활성화되면 세포질에서 원형질막으로 이동하여 ATP나 GTP의 γ 인산기(제일 끝 혹은 마지막 인산기)를 스핑고신으로 전달한다. S1P 수용체는 GPCR로 S1P는 G 단백질 신호전달을 조절할 수 있는 능력을 지닌다. 결과적으로 ERK, Rho GTPase, Rac GTPase 인지질분해효소 C(phospholipase C, PLC) 그리고 AKT/P13K와 같은 세포내 인자를 활성화한다. 또한 세포 내의 표적 분자에 효과를 발휘한다. S1P는 히스톤 탈아세틸효소(histone deacetylase, HDAC)의 탈아세틸 활성을 직접적으로 저해한다. 반대로 탈인산화된 스핑고신은 세포자살을 촉진하고 따라서 스핑고신 인산화효소의 조절을 이해하는 것이 중요하다. 스핑고신 인산화효소가 세포증식을 촉진하고 SK1(스핑고신 인산화효소의 한 종류)이 특정 유형의 암에서 고농도로 존재한다는 점을 미루어 보아 스핑고신 인산화효소가 암세포의 성장을 지속시킬 가능성이 있다. 포유동물 세포에는 SK1와 SK2 두 종류의 스핑고신 인산화효소가 존재한다. SK1이 SK2에 비하여 더 특이적이고, 그들의 발현 유형도 상이하다. SK1은 폐, 비장, 림프구에 발현되는 반면 SK2은 신장과 간세포에서 발견된다. 이 두 인산화효소는 세포생존, 증식, 분화 및 염증과 연관이 있어 화학요법의 대상이 된다.[19]
탄수화물 인산화효소[편집]
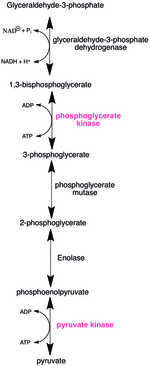
많은 포유동물에게 탄수화물은 일일 열량 필요량의 대부분을 공급한다. 올리고당에서 에너지를 얻기 위해서는 우선 단당류로 분해되어 세포대사로 들어가야 한다. 인산화효소는 거의 모든 대사 경로에서 중요한 역할을 한다. 그림은 해당(glycolysis)의 두 번째 시기를 보여준다. 1,3-이인산 글리세르산의 무수결합은 불안정하고 높은 에너지를 가진다. 1,3-이인산 글리세르산 인산화효소는 ADP를 이용하여 3-인산 글리세르산과 ATP를 생산한다. 해당의 마지막 과정에서 피루브산 인산화효소는 포스포엔올피루브산의 인산기를 ADP로 전달하여 ATP와 피루브산을 생산한다.
헥소키나아제(헥소인산화효소, Hexokinase)는 포도당이 처음 세포 내로 들어가게 하는 일반적인 효소이다. ATP의 감마 인산기를 D-포도당의 C6로 전달하여 포도당-6-인산으로 전환한다. 인산기의 음전하로 인해 포도당-6-인산은 세포질 내에 머무르고 해당 과정으로 들어갈 수 있다. 탈인산화된 형태의 포도당은 다시 세포막을 거쳐 세포 바깥으로 쉽게 유출된다.[20] 헥소키네이스에 돌연변이가 생기면 헥소키네이스 결핍 상태로 비구형 용혈성 빈혈(nonspherocytic hemolytic anemia)이 생길 수 있다.[21]
인산과당 인산화효소(Phosphofructokinase, PFK)는 과당-6-인산을 과당-1,6-이인산으로 전환한다. 이 반응은 해당의 중요한 조절 반응이다. ATP나 H+, 그리고 시트르산의 농도가 높으면 인산과당 인산화효소를 저해한다. 시트르산 농도가 높으면 해당이 적정 속도로 일어나고 있다는 것을 의미한다. 아데노신 일인산의 농도가 높으면 인산과당 인산화효소의 활성이 높아진다. 제 7형 당원저장병(glycogen strage disease 혹은 Tarui's disease)는 인산과당 인산화효소 유전자에 돌연변이가 생겨 활성이 낮아졌기 때문에 유발된다.[22]
기타[편집]

인산화효소는 단백질, 지질, 탄수화물 이외의 분자에도 작용한다. 뉴클레오티드 상호전환에 관련된 효소로 뉴클레오시드 인산 인산화효소와 뉴클레오시드 이인산 인산화효소가 있다.[24] 인산화효소의 기질이 되는 기타 작은 분자들에는 크레아틴, 인산글리세르산, 리보플라빈, 다이하이드록시아세톤, 시킴산(shikimate) 등등이 있다.
리보플라빈 인산화효소[편집]
리보플라빈 인산화효소(Riboflavin kinase)는 리보플라빈을 인산화하여 플라빈 모노뉴클레오티드(flavin mononucleotide, FMN)을 만든다. 이 반응에서는 리보플라빈이 ATP 분자와 결합하기 전에 인산화효소와 먼저 결합하여야 한다.[25] 이가양이온이 뉴클레오티드 배위결합을 돕는다.[25] 대략적인 기작이 아래 그림에 나타나 있다.

리보플라빈 인산화효소는 세포에서 중요한 역할을 한다. FMN은 중요한 보조인자이며, 산화환원반응의 보조인자인 플라빈 아데닌 디뉴클레오티드(flavin adenine dinucleotide, FAD)의 전구체이기도 하다. 몇몇 효소는 리보플라빈을 FMN으로, FMN을 FAD로 인산화하는 반응 모두를 수행할 수 있다.[26] 리보플라빈 인산화효소는 뇌졸중 예방과 관련이 있고 미래에는 치료에 이용될 가능성이 있다.[27] 마우스를 이용한 연구에서는 감염과 연관이 있다는 것이 보고되었다.[28]
티미딘 인산화효소[편집]
티미딘 인산화효소(Thymidine kinase)는 뉴클레오시드 인산화효소 중 하나로 뉴클레오시드 인산화를 담당한다. 아래에서 보이는 것과 같이 ATP 분자에서 인산기를 티미딘에 전달하여 티미딘 일인산(thymidine monophosphate, dTMP)을 생산한다. 티미딘 인산화효소를 비롯한 다른 뉴클레오시드와 뉴클레오티드 인산화효소는 뉴클레오티드의 수준을 조절하는 역할을 한다.

dTMP 분자를 생성한 후에 티미딜산 인산화효소가 dTMP에 작용하여 이인산 형태인 dTDP를 생성하고, 또 다른 효소가 작용하여 dTTP를 생산하여 DNA 합성에 이용된다. 즉 티미딘 인산화효소의 활성은 세포주기와 밀접한 연관이 있으며 암세포에서 활성이 증가할 수 있고,[29] 그러므로 때로 환자의 예후를 측정하는데 이용될 수 있다.[30] 티미딘 인산화효소 유전자에 돌연변이가 있는 환자는 아동기에 죽음에 이르게 할 수 있는, 특정한 종류의 미토콘드리아 DNA 결핍 증후군을 겪을 수 있다.[31]
갈락토키나아제 결핍[편집]
갈락토키나아제 결핍(galactokinase缺乏)은 갈락토키나아제가 선천적으로 결핍된 대사 장애이다. 혈액 속의 갈락토오스 수치가 증가되고 백내장, 간 종대, 정신 지체 따위의 증상을 보일수있다.
글루코키나아제[편집]
글루코키나아제(glucokinase)는 간에서 합성되는 효소로 포도당을 글루코오스육인산(G6P)으로 변환시킨다.
단백질 키나아제 단백질키나아제(蛋白質Kinase)는 단백질을 인산화하는 효소의 하나이다. ATP의 감마 위치의 인산기를 떼어 내어 단백질에 부착시킨다. 외부 자극을 세포 내로 전달하는 데 중요한 역할을 한다.
같이 보기[편집]
- G 단백질 연결 수용체
- 뮤타아제(mutase)
출처[편집]
- ↑ Siebold, C; Arnold, I; Garcia-Alles, LF; Baumann, U; Erni, B (2003년 11월 28일). “Crystal structure of the Citrobacter freundii dihydroxyacetone kinase reveals an eight-stranded alpha-helical barrel ATP-binding domain.”. The Journal of biological chemistry (영어) 278 (48): 48236–44. PMID 12966101.
- ↑ Krebs, EG (1983년 7월 5일). “Historical perspectives on protein phosphorylation and a classification system for protein kinases.”. Philosophical transactions of the Royal Society of London. Series B, Biological sciences (영어) 302 (1108): 3–11. PMID 6137005.
- ↑ Linn, TC (1969년 9월). “Alpha-keto acid dehydrogenase complexes. XI. Comparative studies of regulatory properties of the pyruvate dehydrogenase complexes from kidney, heart, and liver mitochondria.”. Proc Natl Acad Sci U S A (영어) 64 (1): 227–234. PMID 6137005.
- ↑ Langan, TA (1969년 12월). “Phosphorylation of liver histone following the administration of glucagon and insulin.”. Proc Natl Acad Sci U S A (영어) 64 (4): 1276–83. PMID 4318347.
- ↑ Scheeff, Eric D.; Bourne, Philip E. (2005). “Structural Evolution of the Protein Kinase–Like Superfamily”. PLoS Computational Biology (영어) 1 (5): e49. doi:10.1371/journal.pcbi.0010049.
- ↑ 가 나 Manning, G; Whyte, DB; Martinez, R; Hunter, T; Sudarsanam, S (2002년 12월 6일). “The protein kinase complement of the human genome.”. Science (New York, N.Y.) (영어) 298 (5600): 1912–34. PMID 12471243.
- ↑ 가 나 Krebs, EG; Tan, ST; Carrow, DJ; Watts, MK (1985년 10월). “The phosphorylation of proteins: a major mechanism for biological regulation. Fourteenth Sir Frederick Gowland Hopkins memorial lecture.”. Biochemical Society transactions (영어) 13 (5): 813–20. PMID 2998902.
- ↑ Samarasinghe, Buddhini. “Hallmarks of Cancer 1:Self-Sufficiency in Growth Signals”. 《Scientific American》.
- ↑ Lahiry, Piya; Torkamani, Ali; Schork, Nicholas J.; Hegele, Robert A. (2010년 1월). “Kinase mutations in human disease: interpreting genotype–phenotype relationships”. Nature Reviews Genetics (영어) 11 (1): 60–74. doi:10.1038/nrg2707.
- ↑ Harper, J. W.; Adams, P. D. (2001년 8월). “Cyclin-Dependent Kinases”. Chemical Reviews (영어) 101 (8): 2511–2526. doi:10.1021/cr0001030.
- ↑ Karp, Gerald (2010). Cell and molecular biology : concepts and experiments (영어) 6판. Hoboken, NJ: John Wiley. ISBN 9780470483374.
- ↑ Lim, S.; Kaldis, P. (2013년 7월 16일). “Cdks, cyclins and CKIs: roles beyond cell cycle regulation”. Development (영어) 140 (15): 3079–3093. doi:10.1242/dev.091744.
- ↑ 가 나 Canavese, Miriam; Santo, Loredana; Raje, Noopur (2012년 5월 1일). “Cyclin dependent kinases in cancer: Potential for therapeutic intervention”. Cancer Biology & Therapy (영어) 13 (7): 451–457. doi:10.4161/cbt.19589.
- ↑ 가 나 Garrington, TP; Johnson, GL (1999년 4월). “Organization and regulation of mitogen-activated protein kinase signaling pathways.”. Current opinion in cell biology (영어) 11 (2): 211–8. PMID 10209154.
- ↑ Sun, Yue; Thapa, Narendra; Hedman, Andrew C.; Anderson, Richard A. (2013년 6월). “Phosphatidylinositol 4,5-bisphosphate: Targeted production and signaling”. BioEssays (영어) 35 (6): 513–522. doi:10.1002/bies.201200171.
- ↑ Heath, CM; 외. (2003). “Lipid Kinases Play Crucial and Multiple Roles in Membrane Trafficking and Signalling” (PDF). Histology and Histopathology (영어) 18: 989–998.
- ↑ Cantley, Lewis C (2012). “PI 3-kinase and disease”. BMC Proceedings (영어) 6 (Suppl 3): O2. doi:10.1186/1753-6561-6-S3-O2.
- ↑ 가 나 다 Miller, S.; Tavshanjian, B.; Oleksy, A.; Perisic, O.; Houseman, B. T.; Shokat, K. M.; Williams, R. L. (2010년 3월 25일). “Shaping Development of Autophagy Inhibitors with the Structure of the Lipid Kinase Vps34”. Science (영어) 327 (5973): 1638–1642. doi:10.1126/science.1184429.
- ↑ Neubauer, Heidi A.; Pitson, Stuart M. (2013년 11월). “Roles, regulation and inhibitors of sphingosine kinase 2”. 《FEBS Journal》 280 (21): 5317–5336. doi:10.1111/febs.12314.
- ↑ Holzer, H; Duntze, W (1971). “Metabolic regulation by chemical modification of enzymes.”. Annual review of biochemistry (영어) 40: 345–74. PMID 4399446.
- ↑ “Nonspherocytic hemolytic anemia due to hexokinase deficiency”. 2015년 9월 5일에 원본 문서에서 보존된 문서. 2014년 6월 22일에 확인함.
- ↑ “Phosphofructokinase Deficiency Glycogen Storage Disease”. 2015년 4월 19일에 원본 문서에서 보존된 문서. 2014년 6월 22일에 확인함.
- ↑ Bauer, S; Kemter, K; Bacher, A; Huber, R; Fischer, M; Steinbacher, S (2003년 3월 7일). “Crystal structure of Schizosaccharomyces pombe riboflavin kinase reveals a novel ATP and riboflavin-binding fold.”. Journal of molecular biology (영어) 326 (5): 1463–73. PMID 12595258.
- ↑ Pratt, Donald Voet, Judith G. Voet, Charlotte W. (2008). Fundamentals of biochemistry : life at the molecular level (영어) 3판. Hoboken, NJ: Wiley. ISBN 9780470129302.
- ↑ 가 나 Karthikeyan, S; Zhou, Q; Osterman, AL; Zhang, H (2003년 11월 4일). “Ligand binding-induced conformational changes in riboflavin kinase: structural basis for the ordered mechanism.”. Biochemistry (영어) 42 (43): 12532–8. PMID 14580199.
- ↑ Galluccio, M; Brizio, C; Torchetti, EM; Ferranti, P; Gianazza, E; Indiveri, C; Barile, M (2007년 3월). “Over-expression in Escherichia coli, purification and characterization of isoform 2 of human FAD synthetase.”. Protein expression and purification (영어) 52 (1): 175–81. PMID 17049878.
- ↑ Zou, YX; Zhang, XH; Su, FY; Liu, X (2012년 10월). “Importance of riboflavin kinase in the pathogenesis of stroke.”. CNS neuroscience & therapeutics (영어) 18 (10): 834–40. PMID 22925047.
- ↑ Brijlal, Sangeetha; Lakshmi, A. V; Bamji, Mahtab S.; Suresh, P. (2007년 3월 9일). “Flavin metabolism during respiratory infection in mice”. British Journal of Nutrition (영어) 76 (03): 453. doi:10.1079/BJN19960050.
- ↑ Aufderklamm, S; Todenhöfer, T; Gakis, G; Kruck, S; Hennenlotter, J; Stenzl, A; Schwentner, C (2012년 3월). “Thymidine kinase and cancer monitoring.”. Cancer letters (영어) 316 (1): 6–10. PMID 22068047.
- ↑ Topolcan, Ondrej; Holubec, Lubos (2008년 2월). “The role of thymidine kinase in cancer diseases”. Expert Opinion on Medical Diagnostics (영어) 2 (2): 129–141. doi:10.1517/17530059.2.2.129.
- ↑ Gotz, A.; Isohanni, P.; Pihko, H.; Paetau, A.; Herva, R.; Saarenpaa-Heikkila, O.; Valanne, L.; Marjavaara, S.; Suomalainen, A. (2008년 6월 21일). “Thymidine kinase 2 defects can cause multi-tissue mtDNA depletion syndrome”. Brain (영어) 131 (11): 2841–2850. doi:10.1093/brain/awn236.
