크루스파동편모충
|
| |
|---|---|
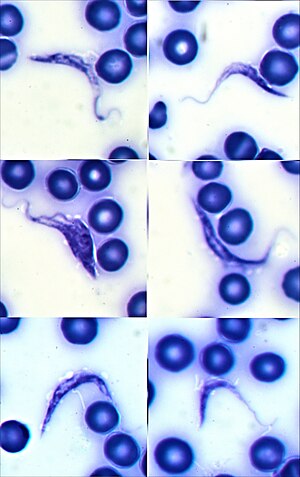 김사 염색된 사람 혈액의 크루스파동편모충. 일반적으로 C 모양으로 보이며 다른 종들에 비해 운동핵이 더 확실히 보인다. | |
| 생물 분류ℹ️ | |
| 역: | 진핵생물역 |
| 문: | 유글레나문 |
| 강: | 운동핵편모충강 |
| 목: | 파동편모충목 |
| 과: | 파동편모충과 |
| 속: | 파동편모충속 |
| 종: | 크루스파동편모충 |
| 학명 | |
| Trypanosoma cruzi | |
| Chagas, 1909[1][2][3] | |
크루스파동편모충(Trypanosoma cruzi)은 유글레나강에 속하는 기생성 종이다. 원생동물 기생충 중에서도 파동편모충(Trypanosoma) 기생충들은 특징적으로 다른 생명체의 조직을 뚫고 들어가 주로 혈액과 림프에서 살아간다. 이로 인해 크루스파동편모충은 숙주마다 서로 다른 질병을 일으킨다. 사람에서는 샤가스병, 말에서는 구역이나 수라증을, 소에서는 브루셀라증과 비슷한 질병을 일으킨다. 기생충은 증식에 숙주의 신체를 필요로 하며 흡혈성 곤충인 트리아토마아과(일명 '키싱버그')가 감염 기전상 주된 매개체이다. 키싱버그는 동물을 물어 흡혈을 할 수 있는 척추동물의 보금자리에서 살아가는 것을 선호한다. 기생충에 감염된 키싱버그는 동물과 접촉해 기생충을 전파한다. 키싱버그는 분변을 숙주의 피부에 배출하며 피부를 물어뜯으며, 이로 인해 기생충에 감염된 분변이 피부를 뚫고 들어간다. 또한 사람이나 동물 숙주는 물린 부위를 긁게 되어 기생충이 침투하기 더욱 쉬워진다.
생활사[편집]

크루스파동편모충의 생활사는 대개 사람이나 야생동물, 가축과 같은 포유류를 동물 저장고로 하여 시작한다. 키싱버그가 매개체의 역할을 한다. 흡혈을 하는 동안 키싱버그는 크루스파동편모충을 함께 섭취한다. 트리아노마 인페스탄스(Triatoma infestans) 같은 키싱버그 종들에서 기생충은 상편모형 단계에 들어서 증식할 수 있게 된다. 이분법을 통해 증식한 후 상편모형의 기생충은 감염성을 가지게 되는 곧창자 세포의 벽으로 움직인다. 감염성 크루스파동편모충은 발육종말형 파동편모충(metacyclic trypomastigote)으로 불린다. 키싱버그가 숙주에서 흡혈하면 전파 단계의 기생충을 포함하는 분변을 배출한다. 이 경로가 기생충의 유일한 전파 경로이다. 1991년 Trumper와 Gorla는 키싱버그의 배변을 중심으로 한 전달 경로를 발견했다.[4][5][6] 파동편모충은 분변에 존재하며 편모를 통해 숙주 세포로 헤엄쳐 들어갈 수 있다. 편모는 주로 원생생물인 유글레나류에서 헤엄치기 위해 사용하는 특징적인 꼬리 구조이다.[7]
파동편모충은 물린 상처나 점막을 통해 숙주로 침투한다. 숙주 세포는 라미닌, 트롬보스폰딘, 황산염 헤파린, 피브로넥틴과 같이 표면을 감싸고 있는 거대분자를 가지고 있다.[8] 이런 거대분자들은 기생충이 숙주에 부착되고 숙주로 침투하는 과정에 필수적이다. 파동편모충은 숙주에 접촉하고 침투하기 위해서 숙주 세포 바깥쪽을 둘러싸고 있는 단백질 망을 가로질러야 한다. 세포골격의 분자와 단백질은 기생충 표면에 결합하여 숙주 침투를 시작한다.[8]
발병기전[편집]
사람에서 파동편모충증은 파동편모충이 혈액에서는 파동편모형으로, 조직에서는 무편모충체로 발달하며 진행된다. 파동편모충증의 급성 형태는 기생충이 침투한 부위에서 국소적인 붓기를 유발할 수 있으나 대부분 눈에 띄지 않는다. 만성 형태는 감염 이후 30-40년이 지난 후에야 발병하여 내장 기관(심장, 식도, 큰창자, 말초신경계)에 영향을 미칠 수 있다.
급성의 경우 니푸르티목스와 벤즈니다졸로 치료할 수 있다. 감염 직후 치료를 시작하면 치료가 가능하다. 만성의 경우 항기생충제 치료가 잠재적으로 질병 진행을 막거나 완화시키고 전파를 예방하는 데에 잠재적으로 효과가 있다.[9]
심장 징후[편집]
샤가스병에 대해 연구한 연구자들은 심근병증에서 발생하는 여러 과정들에 대해 밝혀냈다. 첫 번째로 일어나는 것은 염증 반응이다. 염증으로 인해 세포가 손상된다. 이 손상을 회복하기 위한 우리 몸의 시도로써 심장 조직에서 섬유화가 발생한다.[10]
만성 샤가스병의 거의 모든 사례에서 발견되는 또 다른 심근병증은 혈전색전증이다. 피가 굳어 형성된 혈전은 혈관을 타고 다른 먼 부위로 이동해 그 부분을 막아 합병증으로 색전증을 주로 일으킨다. 이렇게 색전증이 일어나면 부정맥, 심장 이완으로 인한 혈액 정체, 벽의 심내막염, 심장 섬유화를 통해 환자를 죽음에 이르게 한다. 혈전은 뇌, 지라, 콩팥 같은 다른 장기에도 영향을 미친다.[11]
심근의 생화학적 반응[편집]
크루스파동편모충을 쥣과 동물에 감염을 유도시켜 진행한 연구에서는 샤가스병의 만성기에서 지속적으로 활성화된(인산화된) 세포외신호 조절 인산화효소(ERK), AP-1, NF-κB를 보인다는 사실을 밝혔다. 또한 체세포분열 G1 과정 조절자인 사이클린 D1이 활성화되는 것이 발견됐다. ERK의 어떤 동형도 증가하지 않지만 크루스파동편모충에 감염된 생쥐에서 인산화된 ERK의 농도가 증가한다. 감염된 생쥐는 대조군에 비해 감염 이후 7일 동안 AP-1의 농도가 매우 높았다. NF-κB도 심근 조직에서 농도가 올라갔으며 혈관에서 농도가 가장 높았다. 한편 웨스턴 블랏을 통해 감염 이후 1일에서 60일까지 사이클린 D1이 상향조절되는 것으로 나타났다. 또한 면역조직화학적 분석에 의해 가장 사이클린 D1을 많이 생산하는 것은 혈관과 심장의 간질 부위라는 것도 밝혀졌다.[12]
심장 리듬 이상[편집]
전기 전도 이상도 크루스파동편모충과 연관되어 있다. 이 전도 이상의 기저에는 심장의 부교감신경계 신경 말단의 감소가 있다. 적절한 부교감신경 분포 없이는 심박수변동성과 근수축성 이상이 모두 발견될 수 있다. 염증성이든 아니든 심장 질환은 부교감신경의 탈신경을 보일 수 있으며 이 탈신경은 샤가스병을 설명하는 특징이기도 하다. 또한 부교감신경 분포를 상실하면 감염의 급성기에 일어나는 심각한 심부전으로 인해 급사할 수 있다는 것도 밝혀졌다.[13]
만성 샤가스병에서 나타나는 또 다른 전도 이상은 심전도에서 T파로 보이는 심실 재분극이 변화하는 것이다. 재분극의 변화는 심장이 이완하기 위해 적절히 이완기에 들어서는 것을 막는다. 샤가스병에서 심실 재분극이 변화하는 것은 심근 허혈로 인한 것일 가능성이 높다. 허혈은 세동으로 이어질 수 있다. 이 징후는 만성 샤가스병에서 대부분 관찰되며 마이너한 심근병증으로 여겨진다.[14]
심외막 병변[편집]
플라크는 바깥에서 성장하며 심외막을 두껍게 만든다. 이는 기생충의 성장이 심외막 중심부가 아닌 경계부에서 일어난다는 것을 의미한다. 이 플라크에는 염증 세포와 혈관 구조가 존재한다.[15]
독성의 화학[편집]
크루스파동편모충은 자체적으로는 프로스타글란딘을 생산하지 않는다. 대신 이 기생충은 마우스가 프로스타글란딘 시리즈2를 과도하게 생산하도록 유도하는 것으로 밝혀졌다.[16] 이런 PG2는 면역억제 활성을 가져 기생충의 면역회피를 돕는다.[16]
이미프라민은 항파동편모충제이다.[16] 이미프라민과 이미프라민의 다양한 유도체인 3-클로로이미프라민, 2-니트로이미프라민, 2-니트로데스메틸이미프라민은 생체외에서 파동편모충을 죽이는 효과를 가지는 것으로 밝혀졌다.[16] 이 중 2-니트로데스메틸이미프라민이 가장 효과적이었다.[16]
역학[편집]
크루스파동편모충의 전파는 미국 남서부에서 기록되어 왔으며 따뜻해지는 기후가 매개체가 되는 곤충 종들이 북쪽으로 이동하도록 할 수 있다. 미국의 가축과 야생 동물은 크루스파동편모충의 저장고 역할을 한다. 미국 남부의 키싱버그는 인간의 혈액을 먹고 살지만 이 곤충들이 일반적인 미국 가정을 생존 환경으로 선호하지 않아 미국에 사는 사람들의 크루스파동편모충 감염 위험은 매우 낮다.[17]
샤가스병은 전 세계적으로 발병하지만 적절한 주거 환경이 갖추어지지 않은 사람들이 고위험군에 속한다. 저장고는 야생 동물이지만 매개체는 키싱버그이다. 샤가스병은 전염병으로 여러 방법을 통해 전파될 수 있다. 전파 방법에는 선천성 감염(감염된 산모로 인해 아기도 감염되는 경우),[18] 수혈,[19] 장기 이식,[20] 감염된 벌레의 분변으로 오염된 음식을 조리하지 않고 섭취했을 때, 실험실에서 사고로 인해 노출되는 경우 등이 있다.[21]
130종 이상의 동물이 이 기생충을 전파시킬 수 있다.[22]
여섯 개의 분류학상의 서브유닛이 알려져 있다.[23]
임상[편집]
잠복기는 숙주가 오염된 분변과 접촉한 뒤 5-14일이다. 샤가스병은 급성기와 만성기의 두 시기를 거친다. 급성기는 2주에서 2달까지 지속될 수 있지만 증상이 사소하고 지속 시간이 짧아 환자가 간과할 수 있다. 급성기의 증상에는 붓기, 발열, 피로, 설사, 간이나 지라의 비대 등이 있다. 만성기 샤가스병은 소화기 증상, 변비, 심부전, 복통 등을 유발한다.[21]
진단 방법에는 현미경 검사, 혈청학적 검사, 기니피그나 생쥐, 쥐에 혈액을 접종하여 기생충을 동정하는 방법 등이 있다.
이용 가능한 백신은 없다. 역학적 관리와 질병 예방을 위해 가장 많이 사용되는 방법은 매개체 조절이다.[24] 기생충 매개체는 살충제를 사용하거나 피부에 방충제를 바르고, 벌레로부터 피부를 보호할 수 있는 옷을 입으며, 여행 중에는 더 좋은 숙박 시설에 머무르는 등 예방적인 방법을 통여 조절할 수 있다. 더 좋은 질의 집에 투자하는 것이 이 병에 걸릴 위험을 줄이는 데에 가장 알맞을 수 있다.[25]
유전자 이동[편집]
크루스파동편모충 개체들 간에 유전자 이동이 있다는 사실이 확인되었다.[26] 이 과정은 유전자 재조합과 감수분열 기전을 수반하는 것으로 나타났다. 크루스파동편모충은 유성생식이 가능하지만 자연 상태에서 이들 개체군은 같은 세포에서 유래한 클론으로 나타난다. 주로 가까운 개체 간에 유성생식이 빈번하게 발생하여 클론 개체군이 분명히 형성된다.[27]
참고 문헌[편집]
- ↑ Chagas, C. (1909). “Neue Trypanosomen: Vorläufige mitteilung” [New trypanosome. Preliminary communication]. 《Archiv für Schiffs-und Tropenhygiene》 (독일어) 13: 120–122.
- ↑ Chagas, Carlos (1909). “Nouvelle espèce de trypanosomiase humaine” [New species of human trypanosomiasis] (PDF). 《Bulletin de la Société de Pathologie Exotique》 (프랑스어) 2 (6): 304–307. 2015년 9월 24일에 원본 문서 (PDF)에서 보존된 문서. 2022년 5월 8일에 확인함.
- ↑ Chagas, C. (1909). “Nova especie morbida do homem, produzida por um Trypanozoma (Trypanozoma cruzi): nota prévia” [New morbid species of man, produced by a Trypanozoma (Trypanozoma cruzi): previous note]. 《Brazil-Medico》 (프랑스어) 23 (16): 161.
- ↑ Krinsky, William L. (2002). Mullen, Gary; Durden, Lance, 편집. 《Medical and veterinary entomology》. Amsterdam Boston: Academic Press. 67–86/xv–597쪽. doi:10.1016/B978-012510451-7/50007-4. ISBN 978-0-12-510451-7. OCLC 50752006. S2CID 82769743. ISBN 0125104510. ISBN 9780080536071.
- ↑ Telleria, Jenny; Tibayrenc, Michel, 편집. (2017). 《American trypanosomiasis Chagas disease : one hundred years of research》. Amsterdam, Netherlands: Elsevier. doi:10.1016/B978-0-12-801029-7.00007-1. ISBN 978-0-12-801029-7. OCLC 971022099. S2CID 82080107. ISBN 0128010290.
- ↑ Sant’Anna, Maurício Roberto Viana; Soares, Adriana Coelho; Araujo, Ricardo Nascimento; Gontijo, Nelder Figueiredo; Pereira, Marcos Horácio (2017). “Triatomines (Hemiptera, Reduviidae) blood intake: Physical constraints and biological adaptations”. 《Journal of Insect Physiology》 (Elsevier) 97: 20–26. doi:10.1016/j.jinsphys.2016.08.004. ISSN 0022-1910. PMID 27521585.
- ↑ Kohl, Linda; Bastin, Philippe (2005). 〈The Flagellum of Trypanosomes〉. Jeon, Kwang W. 《A Survey of Cell Biology》 (PDF). International Review of Cytology 244. 227–85쪽. doi:10.1016/S0074-7696(05)44006-1. ISBN 978-0-08-045779-6. PMID 16157182.
- ↑ 가 나 Ley, Victoria; Andrews, Norma W.; Robbins, Edith S.; Nussenzweig, Victor (1988). “Amastigotes of Trypanosoma cruzi sustain an infective cycle in mammalian cells”. 《Journal of Experimental Medicine》 168 (2): 649–59. doi:10.1084/jem.168.2.649. PMC 2189010. PMID 3045248.
- ↑ “Chagas disease” (영어). 2022년 5월 8일에 확인함.
- ↑ Leiby, David A.; Herron Jr, Ross M.; Read, Elizabeth J.; Lenes, Bruce A.; Stumpf, Robert J. (2002). “Trypanosoma cruzi in Los Angeles and Miami blood donors: Impact of evolving donor demographics on seroprevalence and implications for transfusion transmission”. 《Transfusion》 42 (5): 549–55. doi:10.1046/j.1537-2995.2002.00077.x. PMID 12084162. S2CID 11997057.
- ↑ Marin-Neto, Jose Antonio; Cunha-Neto, Edécio; MacIel, Benedito C.; Simões, Marcus V. (2007). “Pathogenesis of Chronic Chagas Heart Disease”. 《Circulation》 115 (9): 1109–23. doi:10.1161/CIRCULATIONAHA.106.624296. PMID 17339569.
- ↑ Huang, Huan; Petkova, Stefka B.; Cohen, Alex W.; Bouzahzah, Boumediene; Chan, John; Zhou, Jian-nian; Factor, Stephen M.; Weiss, Louis M.; Krishnamachary, Mohan; Mukherjee, Shankar; Wittner, Murray; Kitsis, Richard N.; Pestell, Richard G.; Lisanti, Michael P.; Albanese, Chris; Tanowitz, Herbert B. (2003). “Activation of Transcription Factors AP-1 and NF- B in Murine Chagasic Myocarditis”. 《Infection and Immunity》 71 (5): 2859–67. doi:10.1128/IAI.71.5.2859-2867.2003. PMC 153290. PMID 12704159.
- ↑ Baroldi, Giorgio; Oliveira, Samuel J.M; Silver, Malcolm D (1997). “Sudden and unexpected death in clinically 'silent' Chagas' disease. A hypothesis”. 《International Journal of Cardiology》 58 (3): 263–8. doi:10.1016/S0167-5273(96)02878-1. PMID 9076552.
- ↑ Valente, Ney; Pimenta, João; Paola, Angelo Amato Vincenzo de (2006). “Estudos eletrofisiológicos seriados do sistema éxcito-condutor do coração de pacientes com cardiopatia chagásica crônica” [Serial electrophysiological studies of the heart's excito-conductor system in patients with chronic chagasic cardiopathy]. 《Arquivos Brasileiros de Cardiologia》 (포르투갈어) 86 (1): 19–25. doi:10.1590/S0066-782X2006000100004. PMID 16491205.
- ↑ Benvenuti, Luiz Alberto; Gutierrez, Paulo Sampaio (2007). “Lesões epicárdicas na cardiopatia chagásica são reflexo de processo inflamatório” [Epicardial lesions in Chagas' heart disease reflect an inflammatory process]. 《Arquivos Brasileiros de Cardiologia》 (포르투갈어) 88 (4): 496–8. doi:10.1590/S0066-782X2007000400022. PMID 17546284.
- ↑ 가 나 다 라 마 Lieb, Julian (2004). “The immunostimulating and antimicrobial properties of lithium and antidepressants”. 《Journal of Infection》 (British Infection Association (Elsevier)) 49 (2): 88–93. doi:10.1016/j.jinf.2004.03.006. ISSN 0163-4453. PMID 15236914.
- ↑ Stevens, Lori; Dorn, Patricia L.; Hobson, Julia; de la Rua, Nicholas M.; Lucero, David E.; Klotz, John H.; Schmidt, Justin O.; Klotz, Stephen A. (2012). “Vector Blood Meals and Chagas Disease Transmission Potential, United States”. 《Emerging Infectious Diseases》 18 (4): 646–649. doi:10.3201/eid1804.111396. PMC 3309679. PMID 22469536.
- ↑ Kemmerling, Ulrike; Osuna, Antonio; Schijman, Alejandro Gabriel; Truyens, Carine (2019). “Congenital Transmission of Trypanosoma cruzi: A Review About the Interactions Between the Parasite, the Placenta, the Maternal and the Fetal/Neonatal Immune Responses”. 《Frontiers in Microbiology》 10. doi:10.3389/fmicb.2019.01854/full. ISSN 1664-302X.
- ↑ Angheben, Andrea; Boix, Lucia; Buonfrate, Dora; Gobbi, Federico; Bisoffi, Zeno; Pupella, Simonetta; Gandini, Giorgio; Aprili, Giuseppe (2015년 10월). “Chagas disease and transfusion medicine: a perspective from non-endemic countries”. 《Blood Transfusion》 13 (4): 540–550. doi:10.2450/2015.0040-15. ISSN 1723-2007. PMC 4624528. PMID 26513769.
- ↑ Kun, Heather; Moore, Anne; Mascola, Laurene; Steurer, Frank; Lawrence, Gena; Kubak, Bernard; Radhakrishna, Suman; Leiby, David; Herron, Ross (2009년 6월 1일). “Transmission of Trypanosoma cruzi by heart transplantation”. 《Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America》 48 (11): 1534–1540. doi:10.1086/598931. ISSN 1537-6591. PMID 19400748.
- ↑ 가 나 “Chagas disease - Symptoms and causes”. 《메이오 클리닉》 (영어). 2022년 5월 8일에 확인함.
- ↑ Monteiro, Fernando Araujo; Weirauch, Christiane; Felix, Márcio; Lazoski, Cristiano; Abad-Franch, Fernando (2018). 〈Evolution, Systematics, and Biogeography of the Triatominae, Vectors of Chagas Disease〉. 《Advances in Parasitology》 99. 265–344쪽. doi:10.1016/bs.apar.2017.12.002. ISBN 978-0-12-815192-1. PMID 29530308.
- ↑ Reis-Cunha, João Luís; Baptista, Rodrigo P.; Rodrigues-Luiz, Gabriela F.; Coqueiro-dos-Santos, Anderson; Valdivia, Hugo O.; de Almeida, Laila Viana; Cardoso, Mariana Santos; D’Ávila, Daniella Alchaar; Dias, Fernando Hugo Cunha; Fujiwara, Ricardo Toshio; Galvão, Lúcia M. C.; Chiari, Egler; Cerqueira, Gustavo Coutinho; Bartholomeu, Daniella C. (2018년 11월 13일). “Whole genome sequencing of Trypanosoma cruzi field isolates reveals extensive genomic variability and complex aneuploidy patterns within TcII DTU”. 《BMC Genomics》 19 (1): 816. doi:10.1186/s12864-018-5198-4. PMC 6234542. PMID 30424726.
- ↑ Quinde-Calderón, Leonardo; Rios-Quituizaca, Paulina; Solorzano, Luis; Dumonteil, Eric (2016). “Ten years (2004–2014) of Chagas disease surveillance and vector control in Ecuador: Successes and challenges” (PDF). 《Tropical Medicine & International Health》 21 (1): 84–92. doi:10.1111/tmi.12620. PMID 26458237. S2CID 25754153.
- ↑ “CDC Works 24/7”. Centers for Disease Control and Prevention. 2016년 4월 16일에 확인함.
- ↑ Messenger LA, Miles MA (2015). “Evidence and importance of genetic exchange among field populations of Trypanosoma cruzi”. 《Acta Trop.》 151: 150–5. doi:10.1016/j.actatropica.2015.05.007. PMC 4644990. PMID 26188331.
- ↑ Berry, Alexander S. F.; Salazar-Sánchez, Renzo; Castillo-Neyra, Ricardo; Borrini-Mayorí, Katty; Chipana-Ramos, Claudia; Vargas-Maquera, Melina; Ancca-Juarez, Jenny; Náquira-Velarde, César; Levy, Michael Z.; Brisson, Dustin; Bartholomeu, Daniella Castanheira (2019년 5월 20일). “Sexual reproduction in a natural Trypanosoma cruzi population”. 《PLOS Neglected Tropical Diseases》 13 (5): e0007392. doi:10.1371/journal.pntd.0007392. PMC 6544315. PMID 31107905.
외부 링크[편집]
- “American Trypanosomiasis (Trypanosoma cruzi)”. 《DPDx—Laboratory Identification of Parasitic Diseases of Public Health Concern》. Centers for Disease Control and Prevention. 2013년 11월 29일.
- “Trypanosoma cruzi”. 《NCBI Taxonomy Browser》. 5693.
