척수성 근위축증
 | |
|---|---|
 | |
| 진료과 | 신경과 |
척수성 근위축증(脊髓性筋萎縮症, spinal muscular atrophy, SMA)은 퇴행성 신경질환의 한 예로, 진핵생물에서 SMN(survival motor neuron) 단백질을 암호화하는 SMN1 유전자 돌연변이에 의해 발생하는 상염색체 열성의 유전적 질환이다.
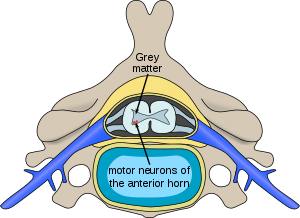
SMN 단백질의 감소는 척수와 뇌간 사이에 존재하는 운동신경세포의 기능손상을 야기시켜 근육의 동작을 명령하는 신호를 받지못해 근육이 방치되며, 근력저하, 근위축 및 섬유속성 연축 등을 일으킨다. 이 질환에는 근육위축에 의한 형태 변형과 기능 장애를 줄이기 위해 관절 가동범위(range of motion)를 유지시키거나 근육의 유연성을 증가시키고, 구축(contracture)을 예방하기 위해 다양한 방법의 물리치료가 처방된다. 발병률은 신생아 6,000~10,000명당 1명 정도이고 40명당 1명꼴로 유전적 보인자로 알려져있다.
역사[편집]
근육을 조절하는 신경세포의 대부분은 척수에 존재한다. 이 신경세포의 신호전달에 문제가 생기면 근육이 움직이지 않게 되고, 그 결과 근육이 작아지는 현상이 나타나므로 척수성 근위축증이라는 명칭이 붙게 되었다.[1]
척수성 근위축증은 1891년 werdnig에 의해 최초로 보고되었다. 1967년경 척수성 근위축증 3가지 타입 분류에 대한 체계가 확립되었고, 2007년 척수성 근위축증 환자의 임상의 치료기준(Standard of care) 문서가 공식화되었다. 1995년에 SMA의 원인이 되는 SMN 유전자에 대해 밝혀졌으며, 이 발견은 SMA 동물모델의 발달과 SMN 단백질 수준을 높이기 위한 치료상의 접근에 대한 연구로 이어졌다. [2]
원인[편집]
가장 전형적인 SMA는 염색체 5번 염색체에 존재하는 SMN 유전자의 돌연변이에 의한 SMN 단백질의 결핍에 의해 발생하는 유전적 질환이다.[3]

SMN 유전자는 운동신경에서 단백질 정보를 전달하는 RNA(mRNA)를 만드는 과정 중에 중요한 역할을 하고, 운동신경이 프로그램된 세포자멸사(apoptosis)에 의해 죽게되는 것을 억제하는 역할을 한다. SMN 단백질의 기능은 척수성 근위축증의 증상과 큰 연관성이 있다.[4] SMN 단백질은 염색체 5번 염색체 13 위치의 SMN1 (telomeric form)과 SMN2 (centromeric form)의 2종류 유전자에 암호화되어있다. SMN1 유전자와 SMN2 유전자는 전체 시퀀스 중 엑손(exon) 7의 6bp 가량이 SMN1은 시토신(cytosine, C), SMN2는 티로신(tyrosine, T)으로 구성되어 있는 차이점을 가지며, 그 결과 SMN1 유전자는 9개의 엑손(exon)의 전사물(transcript)로 294개의 아미노산을 생산하고, 엑손 7번 말단에 종결코돈이 존재해 엑손 8번은 전체 SMN 단백질에 포함되지 않는다. 그러나 SMN2 유전자는 낮은 수준의 SMN 단백질이 생산되고, 엑손 7이 결핍된(SMN△7) 비정상적인 형태의 SMN 단백질이 생산되어, 기능을 하지 못하거나 빠르게 분해된다. 95%의 SMA 환자의 경우, SMN1 유전자의 돌연변이가 일어나 발병하게 되며, SMN 단백질의 감소로 인한 운동신경의 결실을 초래한다.[5][6][7]
증상 및 분류[편집]
증상[편집]
SMA 타입, 질환의 단계, 개인차에 따라 그 증상이 매우 다르나 일반적으로는 아래와 같은 증상을 보인다.
- 팔, 다리의 심부건 반사 소실
- 대칭성 근육약화, 근긴장저하
- 얼굴근육 기능 저하
- 혀 근육의 근육수축
분류[편집]
SMA는 발병시기, 중한 정도, 침범부위, 유전양상 등 임상적 기준으로 제 1형에서 제4형으로 분류된다. [8]
-
|
발병시기
|
증상
|
제 1형
|
출생 후 6개월 미만 | Werdnig-Hoffmann disease
가장 흔하게 발생하는 타입(약 50% 차지) 도움 없이 앉는 것 불가능함, 근긴장저하, 대칭 이완성마비, 머리 제어 불가능, 안면근육 영향, 호흡곤란 등의 증상 보임 2년 이내에 사망함 |
제 2형
|
출생 후 7~18개월 | Intermediate
도움 없이 앉거나 서있는 것은 가능하나 독립적인 보행 불가능, 심부건 반사가 소실, 미세떨림현상, 관절 구축이나 척추만곡증 등의 증상 보임 유아기까지 생존가능함 |
제 3형
|
출생 후 18개월 이상 | Kugelberg-Welander disease
독립적인 보행 가능하나, 유아기-점진적인 근육 약화 발생, 일부는 소아기-휠체어 등의 도움 필수적, 척추측만증이 흔히 발생하며, 보행능력을 잃은 환자는 비만, 골다공증이 발생함 |
제 4형
|
성인기 | 30세 이후 근육약화 시작
보행 가능, 호흡, 영양문제 없음 합병증 동반: 척추측만증, 관절경축, 폐렴, 대사성 산증 등 |
진단[편집]
척수성 근위축증은 증상, 유전, 혈중 크레아틴 키나아제(Creatine kinase:CK) 농도, 유전자 검사, 근전도 검사, 양수검사, 융모막융모샘플링 검사 등을 통해 진단할 수 있다.[9][10][11]
혈액검사[편집]
근육 세포질에 존재하는 효소인 크레아틴 키나아제는 근육 손상 시 혈청 내로 유입되며, 이 효소의 혈중농도 수치변화를 통해 근육 손상여부, 발병 여부를 검사할 수 있다. 근육 위축 증상 발생 이전에 검사 가능하며, 제 1형에서는 크레아틴 키나아제 수치가 정상으로 나타나지만, 2, 3, 4형에선 정상보다 높은 수치가 검출되며, 수치를 이용해 진단 가능하다.
근전도검사[편집]
근전도 기기를 이용하여 근육의 전기적 활성도를 확인하는 검사이다. 척수성 근위축증 환자의 경우 금전도 검사시 세동전위, 양성예파, 복합연속방전이 특징적으로 나타난다.
- 신경전도검사(nerve conduction studies)
- 반복신경자극검사(repetitive nerve stim ulation test: RNS)
- 순목반사검사(blink reflex)
- 침근전도검사(needle EMG)
근육생체검사(Muscle biopsy)[편집]
피부 절개과정 없이 근육 위축 확인이 가능하며, 신경근육계 질환과 척수성 근위축증을 구분할 수 있다. 또한 채취한 조직을 이용하여 DNA 추출 후 분자생물학적 유전자 검사를 통해 SMN 유전자의 돌연변이를 확인할 수 있다. 국소부위 관찰을 위해 길이 5~10mm, 직경 4~5mm 크기의 표본을 채취하며, 진행성 근위축증, 염증성 근질환, 대사성 근육병 진단 등이 가능하다. 근질환의 경우 감각근, 이두근, 대퇴사두근 등에서 검사를 한다.
분자생물학적 유전자 검사[편집]
근육생체검사 표본, 체액, 혈액으로부터 추출한 DNA를 검사하여, SMN 유전자의 돌연변이 여부를 확인한다.
양수검사(amniocentesis)[편집]
임신한 여성의 복부(abdomen)에 가느다란 바늘을 삽입하여 양수에 존재하는 태아의 DNA를 채취하여 분석하는 방법이다. 임신 14주차 이후부터 검출 가능하며, 이 검사를 진행하는 중 유산 위험성이 1/200정도 존재한다.
융모막융모샘플링 (chorionic villus sampling)[편집]
융모막 조직검사(chorion biopsy)라고도 하는 태아의 질환 정보를 얻을 수 있는 검사법이다. 융모막은 양막 바깥에서 태아를 감싸는 막으로, 가느다란 침을 자궁속에 삽입하여 조직을 검출 할 수 있다. 임신 10주차 이후부터 검사가 가능하며, 이 검사를 진행하는 중 유산 위험성이 1/100정도 존재한다.
치료법[편집]
약물[편집]
- 뉴시너센 (스핀라자)은 SMA에 최초로 허가된 약물이다. 2016년 미국부터 허가된 치료제다.[12][13][14]
- 오나셈노진아베파르보벡 (졸겐스마)은 2019년 5월부터 미국부터 허가된 유전자 치료제다.[15][16]
- 리스디플람 (에브리스디)은 2020년 8월부터 미국부터 허가된 치료제다.[17]
기타[편집]
- 척추근육의 약화로인해 척추후만증, 척추측만증이 유발되므로 물리치료와 정형외과적 치료를 받아야한다.
- 몸을 지지하고, 걷는것을 도와줄 수 있는 지지대를 사용한다.
- 폐 근육이 약화되므로 호흡기 감염, 폐렴에 노출되기 쉬우므로 호흡능력을 향상시키기위해 양압기를 사용하고, 필요에따라 기관절개를 실시한다.
- 턱 움직임, 음식을 씹거나 삼키는 것이 어려우므로 영양실조에 걸리기 쉽다. 지방 섭취량을 줄이고, 단식을 피해야한다.
연구적 접근[편집]
저분자(small molecule)을 이용한 접근[편집]
- Histone deacetylase inhibitor (히스톤디아세틸레이즈 억제제)는 SMN2 유전자의 히스톤 단백질을 아세틸화(acetylation)시켜 전사인자(transcription factor)의 접근이 용이하게 만들어 SMN2 유전자의 전사(transcription)를 활성화 시키는 역할을 한다. 대표적인예로 Valproic acid가 있다.[18]
- SMN의 결핍은 운동시스템을 파괴하고, 운동 네트워크 기능을 억제하므로 FDA에서 승인받은 4-aminopyridine (4-AP) 약물을 이용하여 K+ 채널을 이용한 모터 순환 민감도를 증가시키는 것은 SMN-의존적 표현형을 교정할 수 있다는 연구가 진행됐다.[19]
- 퇴행성 신경질환 중 운동신경에 문제가 생기는 질병은 점진적으로 대뇌, 척수 내 운동신경이 죽어나가는데, 이를 보완하기 위해 TRO19622(Olesoxime) 약물을 처리하여 신경보호 효과를 검증하였고[20], SMA 환자에게 처리하여 질병 진행속도가 늦춰짐을 확인하였다.[21]
RNA 기반 접근[편집]
- 안티센스 올리고뉴클레오타이드(antisence oligonucleotide, AO)는 치료상의 RNA 분자로, 인트론(intron)이나 엑손(exon)내의 특정 시퀀스를 타겟으로하여 스플라이싱(splicing)을 강화하거나 방해하는 역할을 한다. AO가 SMN2 exon 7의 스플라이싱을 촉진하고, 그 결과 척수에서 SMN 단백질 발현이 50%까지 증가한다.[22]
유전자 치료적 접근[편집]
- 자가보완적인(self-complementary) adeno-associated virus 9 을 매개하여 SMN 유전자를 교체하여 SMA 마우스에서 생존력과 운동 기능이 향상됨을 확인하였다.[23]
줄기세포(Stem cells)를 이용한 접근[편집]
SMA 환자는 유아기에 사망하기 때문에 연구를 위한 샘플 확보의 어려움이 있었다. 그러나, 환자 유래 유도만능 줄기세포주를 이용한 연구가 진행되면서 이 점이 보완되었고, 유도만능 줄기세포주를 이용한 질병-모델링이 가능해져 질병 메커니즘 연구가 가능해졌다.[24]
- 척수 신경줄기세포를 분리하여 심각한 SMA 마우스의 척추강내(intrathecal)에 주입하여 마우스의 생존기간, 운동행동(motor behavior)능력이 증가하고, 운동신경의 수, 크기가 증가함을 확인하였다.[25][26]
- 고순도의 운동신경 전구세포(motor neuron progenitor cell)을 얻어 SMA 마우스 모델에 주입한 결과, 신경병리학적, 표현형이 향상된 것을 확인하였다.[27]
- SMA 환자 유래 섬유아세포로부터 인간 유도만능줄기세포주(induced pluripotent stem cells, iPSCs)를 확립하였고, iPSC를 신경으로 분화시켜 질병 모델링 및 약물 스크리닝을 시도하였다.[28][29]
각주[편집]
- ↑ “Muscular Dystrophy - "The Home of MDA"”. 2016년 5월 6일에 원본 문서에서 보존된 문서. 2016년 4월 22일에 확인함.
- ↑ Kolb, SJ; Kissel, JT (2011년 8월). “Spinal muscular atrophy: a timely review.”. 《Archives of neurology》 68 (8). PMID 21482919.
- ↑ Brzustowicz, LM; Lehner, T; Castilla, LH; Penchaszadeh, GK; Wilhelmsen, KC; Daniels, R; Davies, KE; Leppert, M; Ziter, F; Wood, D (1990년 4월 5일). “Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2-13.3.”. 《Nature》 344 (6266). PMID 2320125.
- ↑ “보관된 사본” (PDF). 2016년 7월 1일에 원본 문서 (PDF)에서 보존된 문서. 2016년 5월 30일에 확인함.
- ↑ Mailman, MD; Heinz, JW; Papp, AC; Snyder, PJ; Sedra, MS; Wirth, B; Burghes, AH; Prior, TW (2001). “Molecular analysis of spinal muscular atrophy and modification of the phenotype by SMN2.”. 《Genetics in medicine : official journal of the American College of Medical Genetics》 4 (1). PMID 11839954.
- ↑ Monani, UR; Lorson, CL; Parsons, DW; Prior, TW; Androphy, EJ; Burghes, AH; McPherson, JD (1999년 7월). “A single nucleotide difference that alters splicing patterns distinguishes the SMA gene SMN1 from the copy gene SMN2.”. 《Human molecular genetics》 8 (7). PMID 10369862.
- ↑ Lefebvre, S; Bürglen, L; Reboullet, S; Clermont, O; Burlet, P; Viollet, L; Benichou, B; Cruaud, C; Millasseau, P; Zeviani, M (1995년 1월 13일). “Identification and characterization of a spinal muscular atrophy-determining gene.”. 《Cell》 80 (1). PMID 7813012.
- ↑ D'Amico, Adele; Mercuri, Eugenio; Tiziano, Francesco D; Bertini, Enrico (2011). “Spinal muscular atrophy”. 《Orphanet Journal of Rare Diseases》 6 (1). doi:10.1186/1750-1172-6-71. PMID 22047105.
- ↑ “보관된 사본” (PDF). 2016년 7월 1일에 원본 문서 (PDF)에서 보존된 문서. 2016년 5월 30일에 확인함.
- ↑ http://amcmg.amc.seoul.kr/asan/depts/amcmg/K/bbsDetail.do?menuId=3804&contentId=247255
- ↑ “보관된 사본”. 2016년 6월 5일에 원본 문서에서 보존된 문서. 2016년 5월 30일에 확인함.
- ↑ “Spinraza (nusinersen) Injection”. 《U.S. Food and Drug Administration (FDA)》. 2017년 1월 18일. 2020년 8월 8일에 확인함.
- ↑ “Spinraza EPAR”. 《European Medicines Agency (EMA)》. 2020년 8월 8일에 확인함.
- ↑ “Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy”. Agence France-Presse (AFP). 2017년 6월 1일. 2017년 6월 1일에 확인함.
- ↑ “Zolgensma EPAR”. 《European Medicines Agency (EMA)》. 2020년 3월 24일. 2020년 8월 8일에 확인함.
- ↑ “Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)”. 《Novartis》 (보도 자료). 2020년 8월 8일에 확인함.
- ↑ “FDA Approves Oral Treatment for Spinal Muscular Atrophy”. 《U.S. Food and Drug Administration (FDA)》 (보도 자료). 2020년 8월 7일. 2020년 8월 7일에 확인함.
- ↑ Baioni, Mariana T. C.; Ambiel, Celia R. (2010년 8월 11일). “Spinal muscular atrophy: diagnosis, treatment and future prospects”. 《Jornal de Pediatria》 86 (4). doi:10.2223/JPED.1988. PMID 20711542.
- ↑ Imlach, WL; Beck, ES; Choi, BJ; Lotti, F; Pellizzoni, L; McCabe, BD (2012년 10월 12일). “SMN is required for sensory-motor circuit function in Drosophila.”. 《Cell》 151 (2). doi:10.1016/j.cell.2012.09.011.
|doi=값 확인 필요 (도움말). PMID 23063130. - ↑ Bordet, T; Buisson, B; Michaud, M; Drouot, C; Galéa, P; Delaage, P; Akentieva, NP; Evers, AS; Covey, DF; Ostuni, MA; Lacapère, JJ; Massaad, C; Schumacher, M; Steidl, EM; Maux, D; Delaage, M; Henderson, CE; Pruss, RM (2007년 8월). “Identification and characterization of cholest-4-en-3-one, oxime (TRO19622), a novel drug candidate for amyotrophic lateral sclerosis.”. 《The Journal of pharmacology and experimental therapeutics》 322 (2). PMID 17496168.
- ↑ “보관된 사본”. 2016년 6월 30일에 원본 문서에서 보존된 문서. 2016년 6월 20일에 확인함.
- ↑ Williams, JH; Schray, RC; Patterson, CA; Ayitey, SO; Tallent, MK; Lutz, GJ (2009년 6월 17일). “Oligonucleotide-mediated survival of motor neuron protein expression in CNS improves phenotype in a mouse model of spinal muscular atrophy.”. 《The Journal of neuroscience : the official journal of the Society for Neuroscience》 29 (24). PMID 19535574.
- ↑ Foust, KD; Wang, X; McGovern, VL; Braun, L; Bevan, AK; Haidet, AM; Le, TT; Morales, PR; Rich, MM; Burghes, AH; Kaspar, BK (2010년 3월). “Rescue of the spinal muscular atrophy phenotype in a mouse model by early postnatal delivery of SMN.”. 《Nature biotechnology》 28 (3). PMID 20190738.
- ↑ Chang, T; Zheng, W; Tsark, W; Bates, S; Huang, H; Lin, RJ; Yee, JK (2011년 12월). “Brief report: phenotypic rescue of induced pluripotent stem cell-derived motoneurons of a spinal muscular atrophy patient.”. 《Stem cells (Dayton, Ohio)》 29 (12). PMID 21956898.
- ↑ Zanetta, Chiara; Riboldi, Giulietta; Nizzardo, Monica; Simone, Chiara; Faravelli, Irene; Bresolin, Nereo; Comi, Giacomo P.; Corti, Stefania (2014년 2월). “Molecular, genetic and stem cell-mediated therapeutic strategies for spinal muscular atrophy (SMA)”. 《Journal of Cellular and Molecular Medicine》 18 (2). doi:10.1111/jcmm.12224. PMID 24400925.
- ↑ Corti, S; Nizzardo, M; Nardini, M; Donadoni, C; Salani, S; Ronchi, D; Saladino, F; Bordoni, A; Fortunato, F; Del Bo, R; Papadimitriou, D; Locatelli, F; Menozzi, G; Strazzer, S; Bresolin, N; Comi, GP (2008년 10월). “Neural stem cell transplantation can ameliorate the phenotype of a mouse model of spinal muscular atrophy.”. 《The Journal of clinical investigation》 118 (10). PMID 18769634.
- ↑ Wyatt, TJ; Rossi, SL; Siegenthaler, MM; Frame, J; Robles, R; Nistor, G; Keirstead, HS (2011). “Human motor neuron progenitor transplantation leads to endogenous neuronal sparing in 3 models of motor neuron loss.”. 《Stem cells international》 2011. PMID 21716648.
- ↑ Ebert, AD; Yu, J; Rose FF, Jr; Mattis, VB; Lorson, CL; Thomson, JA; Svendsen, CN (2009년 1월 15일). “Induced pluripotent stem cells from a spinal muscular atrophy patient.”. 《Nature》 457 (7227). PMID 19098894.
- ↑ Du, ZW; Chen, H; Liu, H; Lu, J; Qian, K; Huang, CL; Zhong, X; Fan, F; Zhang, SC (2015년 3월 25일). “Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells.”. 《Nature communications》 6. PMID 25806427.
외부 링크[편집]
