조직공학
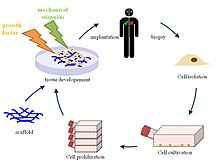
조직공학(組織工學, 영어: tissue engineering)은 생물학적 조직을 개선하거나 대체하기 위해 세포, 공학 및 재료 방법, 적절한 생화학 및 물리 화학적 요인의 조합을 사용한다. 조직공학이란 (줄기)세포, 세포가 부착되어 자랄 수 있는 지지체, 그리고 세포의 성장 및 분화를 조절할 수 있는 각종 인자를 적절히 이용하여 여러 조직 재생, 및 나아가 장기복원을 목표로 하는 연구를 통칭하는 학문이다.[1] 조직공학은 의료 목적을 위한 새로운 생체 조직의 형성을 위한 발판(scaffold)의 사용을 포함한다. 한때 생체 물질(biomaterial)의 하위 분야로 분류되었지만 범위와 중요성이 커지면서 독립적인 분야로 간주될 수 있다.
조직공학의 대부분의 정의가 광범위한 응용 분야를 다루는 반면, 실제로 이 용어는 조직의 일부 또는 전체 (즉, 뼈, 연골[2], 혈관, 방광, 피부, 근육 등)의 개선 또는 대체하는 응용분야와 밀접하게 관련되어 있다. 종종, 관련된 조직은 적절한 기능을 위해 특정한 기계적 및 구조적 특성을 필요로 한다. 이 용어는 인위적으로 생성 된 지지 시스템 (예 : 인공 췌장 또는 생물 인공 간) 내의 세포를 사용하여 특정 생화학 기능을 수행하려는 노력에도 적용되었다. 재생 의학이라는 용어는 조직공학과 동의어로 사용되는 경우가 많지만 재생 의학과 관련된 용어는 줄기세포 또는 전구 세포(en:progenitor cells)를 사용하여 조직을 생산하는 데 더 중점을 둔다.
개요[편집]

랭거(Langer)[3]와 바캉티(Vacanti)[4]에 의해 일반적으로 적용되는 조직공학의 정의는 "생물학적 조직 기능 또는 전체 기관(organ)을 복원, 유지 또는 개선하는 생물학적 대체물의 개발에 대한 공학 및 생명 과학의 원리를 적용하는 학제 간(융합) 분야이다".[5] 조직공학은 또한 "조직 성장 원리를 이해하고 임상 적용을 위한 기능적 대체 조직을 생산하기 위해이 기술을 적용하는 것"으로 정의되어 있다.[6] 추가 설명은 "조직공학의 기본 가정은 시스템의 자연 생물학의 사용이 조직 기능의 대체, 개선, 유지 및 / 또는 향상을 목표로하는 치료 전략을 개발함에 있어 더 큰 성공을 가능케 할 것이라는 점이다."[6]
조직 공학을 간략히 설명하면, 환자의 조직에서 분리하여 배양한 세포들을 생분해성 고분자 물질로 만든 다공성의 지지체(스캐폴드)에 부착시켜 이식하거나 체외에서 일정 기간 동안 배양하여 새로운 생체조직을 만드는 것이다. 세포는 부착해서 자라려는 성질이 있기 때문에 이 환경을 제공하여 줄 지지체가 필요하다. 다공성의 스캐폴드는 삼차원적 구조물을 제공하여 세포가 부착하고 분열하여 새로운 조직을 형성하도록 한다. 이식된 세포가 세포외 기질을 분비하며 조직을 형성하는 동안 생분해성 고분자 물질로 만든 지지체는 분해되어 몸 밖으로 배출되어 인체조직의 성분과 같은 성분을 가진 새로운 조직이 형성된다.
조직공학을 이용해 만들어진 새로운 조직이 원래 기능을 가지기 위해서는 이식된 세포의 유전자 발현이 조직형성 과정 중 적절하게 제어되어야 한다. 세포의 유전자 발현은 주위 환경과의 상호작용에 의해 조절되는데, 이 상호작용에는 세포부착 표면과의 작용, 성장인자나 호르몬과의 작용, 그리고 물리적 자극과의 작용이 있다. 인체의 조직에서 콜라젠 등의 세포외 기질이 세포부착 영역, 성장인자, 그리고 물리적 자극을 제공하듯이, 조직공학에서는 지지체가 이들 특정인자들을 이식된 세포에 적절하게 제공하여야 한다.[1]
세포[편집]
조직 공학은 살아있는 세포를 이용한다. 살아있는 세포는 이식 후 이식물로 이동하거나, 이식 전에 세포배양에서 매트릭스(matrix)와 연관될 수도 있다. 이러한 세포는 재생성되길 원하는 조직의 완전히 분화된 세포로서 분리되거나, 다른 조직 또는 줄기세포 공급원으로부터 분리될 때 원하는 기능을 생성하도록 조작될 수 있다.[7] 조직공학에 이용되는 세포에 대해 알아보면 초기에는 케라틴세포, 섬유모세포, 연골세포 등 성체세포를 이용하였으나 배양과정에서 세포성상이 바뀔 수 있고, 증식에 한계가 있어 최근에는 다양한 분화능과 무한한 자가재생능을 지닌 줄기세포가 주로 이용되고 있다. 특히 배아줄기세포는 전분화능이 있어 모든 조직으로 분화될 수 있으나 그 불안정성과 기형종 발생 가능성이 문제시 된다. 골수조직이나 지방 조직에 있는 중배엽성 성체줄기세포는 골세포, 연골연골세포, 지방세포, 근세포 등으로 분화시킬 수 있어 조직공학 연구에 많이 이용된다.[8]
조직공학에 이용되는 세포는 사용되는 공급원이 자가(autologous)인지, 동종(allogenic)인지, 이종성(xenogeneic)인지 구별된다. 표에서 보여주는 것처럼 각각의 장단점이 있다.[9] 조직공학에 이용되는 세포는 면역거부 반응을 피하기 위해서 자가세포가 바람직하다.[8]
| 종류 | |
|---|---|
| 자가(Autologous) | 환자 자신의 세포;
면역 거부 반응이 없지만, 숙주로부터 제공받지 않는이상 즉시 사용할 수 없음. |
| 동종(allogeneic) | 다른 사람의 세포;
즉시 사용가능하지만, 면역 거부 반응이 있을 수도 있음. |
| 이종(xenogeneic) | 다른 종:
면역 거부 반응이 있을 수도 있을 뿐만 아니라, 동물 바이러스 전파와 관련이 있음. |
줄기세포[편집]
조직 공학의 주요 초점은 줄기세포 기능을 제어하는 수단으로서 적절한 특성을 기능성 갖는 중합체를 이용하는 것이다. 줄기세포의 분화 잠재력에 기초하여, 조직 공학에 사용되는 줄기세포는 pluripotent stem cell(전분화능 줄기세포) 과 mutipotent stem cell(다능성 줄기세포)의 두가지 범주로 나눌 수 있다. 전분화능 줄기세포에는 배아줄기세포뿐만 아니라 유도만능줄기세포를 포함한다.[10]
스캐폴드[편집]

혈액 세포와는 달리, 인간 조직 대부분의 정상 세포들은 세포외 기질(extracellular matrix, ECM)라 불리는 고체형 매트릭스와 상호작용하며 살아간다. 조직 공학 분야는 조직과 기관의 재생을 위한 적절한 환경을 제공하기 위해 다공성 3D 스캐폴드의 사용에 의존한다. 이 스캐폴드는 조직 형성을 위한 주형으로 작용하고, 세포 및 성장 인자들이 '심어져 있거나', 생물반응기 형태의 생체 물리적 자극을 받는다.[11] 엔지니어링된 조직을 위한 최상의 스캐폴드는 본래 상태의 타겟 조직의 세포외 기질이어야 한다. 그러나, 본래 조직에서의 다중 기능, 복잡한 구성 및 세포외 기질의 동적 성질은 정확하게 모방하기 어렵다. 그래서 조직 공학에서 스캐폴딩의 개념은 부분적으로 본래의 세포외 기질의 기능을 모방하는 것이다. 즉, 엔지니어링된 조직에서 스캐폴드가 수행하는 중요한 역할은 본래 조직에서 세포외 기질의 기능과 유사하며 건축학적, 생물학적, 기계적 특징과 관련이 있다.[12]
- 생체 적합성: 조직공학에서 스캐폴드의 첫번째 기준은 생체 적합성이어야 한다. 스캐폴드는 in vitro culture (인 비트로, 시험관 내 배양) 및 in vivo implantation (인 비보, 생체 내 이식) 동안 외부에서 제공되거나 내인성 세포(endogenous cell)이 부착, 성장 및 분화되도록 지원해야한다. 세포는 새로운 매트릭스 아래에 놓이기 전에 부착되어야 하고, 정상적으로 기능하며, 표면 위로 이동하고, 결국 스캐폴드를 통해 증식하기 시작해야한다. 이식 후, 스캐폴드 또는 엔지니어링된 조직 구조물은 면역 거부 반응을 막기 위해[11] 스캐폴드를 제조하는데 사용된 생체 물질(biomaterial)은 숙주 조직에서 조작된 조직 및 내인성 세포의 구성 성분과 호환적이어야 한다.
- 건축학적 특징: 스캐폴드는 이식시 숙주 조직과의 통합을 촉진하기 위해 혈관생성화, 새로운 조직 형성 및 리모델링을 위한 빈 공간을 제공해야 한다. 스캐폴드를 구성하는 생체 물질들은 스캐폴드의 기계적 안정성을 크게 손상시키지 않으면서 효율적인 영양소 및 대사 산물 수송을 위한 높은 다공성의 구조를 제공하도록 가공되어야 한다. 더욱이, 생체 물질은 발생되는 조직에 의해 새롭게 만들어지는 매트릭스 생산 속도에 맞추어 이식 후 분해될 수 있어야 한다(생분해성).[13]
- 생체 활성: 스캐폴드는 엔지니어링된 조직의 세포 구성 요소와 활발하게 상호작용하여 활동을 촉진하고 조절할 수 있다. 생체 물질은 부착력을 향상시키기 위한 세포-부착 리간드와 같은 생물학적 신호 또는 세포 모양 및 정렬에 영향을 주는 물리적 신호를 포함 할 수 있다. 또한 스캐폴드는 재생 속도를 높이기 위한 성장 인자와 같은 외부 성장 자극 신호를 위한 전달 수송체 또는 저장소로서 작용할 수 있다. 이와 관련하여, 생체 물질은 생체분자와 호환될 수 있어야 하며, 생체 활성이 유지된 생체분자의 방출을 제어하기 위한 캡슐화 기술을 사용할 수 있어야 한다.
- 기계적 성질: 스캐폴드는 조직 결함에 기계적 및 형태 안정성을 제공한다. 스캐폴딩에 사용되는 생체 물질의 고유한 기계적 특성 또는 프로세싱 후 특성은 숙주 조직의 고유한 기계적 특성과 일치해야 한다.[12]
재료[편집]
스캐폴드를 구성하는 많은 물질들(천연 및 합성 물질, 생분해성 및 영구 물질 등)이 연구되었다.[14] 이들중 대부분은 이미 생체 흡수성 봉합 재료로 사용되는 연구 주제로서, 조직 공학이 등장하기 이전에 의료 분야에서 알려져왔다. 이들 물질의 예로 콜라겐 및 일부 폴리에스테르가 있다. 폴리락트산 (PLA), 폴리글리콜산 (PGA), 폴리카프롤락톤 (PCL)과 같은 폴리 락톤과 복합체들은 생체 적합성이 우수하기 때문에 고정물로 가장 일반적으로 사용되는 합성 생분해성 폴리머가되고 있다.[15]
새로운 생체 물질은 이상적인 특성과 주입 가능성, 합성 제조, 생체 적합성, 면역 적합성, 투명성, 나노 크기의 섬유, 저농도, 재흡수율 등 기능적으로 맞춤화되도록 설계되었다. Zhang, Rich, Grodzinsky, Langer의 MIT 연구실에서 만들어진 PuraMatrix는 현재 상용화되어 임상 조직 공학에 영향을 미치는 새로운 생체 모방 스캐폴드 제품군 중 하나이다.[16]
일반적으로 사용되는 합성 물질은 폴리락트산(PLA, polylactic acid)이다. PLA는 인체 내에서 분해되어 몸에서 쉽게 제거할 수 있는 젖산(lactic acid)를 형성하는 폴리 에스테르이다.[17] 폴리글리콜산도 다양한 의료 분야에서 이용되는 생분해성 지방족 폴리에스테르이다. 이 PGA의 모노 필라멘트들은 in vivo(생체 내)에서 2-4주만에 분해될 수 있다.[18] 폴리카프롤락톤은 폴리락트산에 비해 분해속도가 굉장히 느리다. 쥐에서의 생체 내 분해가 3년동안이나 관찰되었다. 그래서 장기간 이식 및 약물 방출 제어 응용분야에서 널리 사용되고 있으나, 느린 분해 속도 등으로 인해 조직 공학에서는 단점을 가지고 있다.[19][20] 주로 쓰이는 폴리에스테르들은 생체 활성 감소로 인한 면역 거부 반응을 포함하여 단점이 있다. 또한 폴리락트산과 폴리글리콜산은 가수분해에 의해 분해되면서 이산화탄소를 생성하고 pH를 낮추어 산성환경을 만들게 된다. 심한 경우 조직 괴사를 유도할 수 있다.[8] 이러한 한계를 극복하기 위해 최근, 폴리에스테르와 하이드로 겔 재료를 통합하여 복합 재료를 개발하고 있다. 하이드로겔은 친수성으로 물을 흡수할 수 있으며 종종 소수성 폴리머(폴리에스테르 등)와 비교해 우수한 생체 적합성을 보인다. 그러나, 하이드로겔은 약한 기계적 강도를 나타내며 압력이나 수증기 조건하에서 재료가 쉽게 변형될 수 있다.[21]
스캐폴드는 천연재료로도 구성될 수 있다. 천연 재료로는 콜라겐, 피브린, 젤라틴같은 단백질, 히알루로난, 아가로스, 알지네이트, 키토산 같은 다당류 등이 있다. 천연 재료로 만들어진 스캐폴드는 일반적으로 우수한 생물학적 호환성을 갖지만, 기계적 안정성이 결여되며, 천연 재료의 공급, 가공, 질병 전파가능성에 대한 문제가 있다.[22]
합성[23][편집]

조직공학 스캐폴드로 사용될 다공성 구조를 만들기 위한 다양한 방법들이 있다. Principles of Tissue Engineering, 3rd(Robert Lanza, Robert Langer, Joseph Vacanti)를 참고해서 작성함.
섬유 결합법(fiber bonding)[편집]
polymer fiber는 세포 부착을 위해 훌륭한 표면적 대 부피 비율을 보이므로 좋은 스캐폴드 재료이다. 가장 초기의 조직 공학 스캐폴드는 기계적 안정성이 결여된 섬유 메쉬, 비결합 PGA 테슬 또는 펠트였다. 이 문제를 극복하기 위해 섬유 결합 기술은 섬유를 교차점에서 서로 결합시키는 방식으로 발전했다. 섬유 스캐폴드의 일반적인 예는 PGA와 PLLA를 사용한다. PGA 섬유들은 짜여진(nonwoven) 메쉬로 배열된다. 중합체의 녹는점 이상의 온도에서 섬유들은 섬유들끼리의 접촉점에서 결합할 것이다. 융용 중합체(melting polymer)의 구조적 붕괴를 방지하기 위해, PGA 섬유는 열처리 전에 캡슐화 과정을 거친다. 염화 메틸렌(methylene chloride)에 용해된 PLLA로 메쉬 섬유를 감싸고 건조시켜 PGA-PLLA 복합 매트릭스를 만든다. 열처리 및 섬유 결합 후, PLLA를 염화메틸렌으로 녹인 후, 진공 건조에 의해 용매를 스캐폴드로부터 제거한다.[24] 또다른 방법으로는 얽혀있는(nonwoven) PGA 섬유 케쉬를 원자화된 PLLA 또는 PLGA 용액으로 분사하면서 회전시키는 방법이 있다.[25] 섬유 결합법으로 생성한 스캐폴드는 단순성, PGA 섬유의 특성 유지, 생체 적합성 재료만 사용, 테슬 또는 펠트 배열에 대한 구조적 이점을 가진다는 점에서 좋은 방법이다. 그러나 기공률 및 기공 크기에 대한 제어, 적합한 용매의 이용가능성, 용해 상태의 두가지 중합체의 무해성, 중합체에 필요한 상대적인 융해 온도 등이 단점으로 나타난다.
전기방사법(electrospinning)[편집]

PGA, PLGA, PCl을 포함한 많은 생체적합성 중합체는 다공성이 90% 이상인 나노섬유의 구조물에 전기적 결합을 할 수 있다.[26] 선택한 폴리머를 적절한 용매(예: 클로로포름에 PCL)에 녹여 준비한다. 폴리머 용액은 주사기에 적재된 후 주사기 펌프를 통해 일정한 비율로 금속 모세관을 통해 배출된다. 고전압(10-15kv)을 모세관에 가하여 폴리머를 접해있는 표면을 향해 배출한다. 얇은 섬유들이 plate에 조립되면서 용매는 증발하고 짜여진(nonwoven) 다공성 비계만 남는다. 섬유 두께, 스캐폴드 직경 및 평균 기공 직경은 중합체 농도, 용매의 선택, 방출 속도, 인가 전압, 모세관 직경, 모세관과 표면 사이의 거리를 포함하는 인자에 의해 조정된다. 이러한 이유로, 전기방사법은 많은 실험실에서 스캐폴드 제조의 일반적인 방법이 되었다.
염침출법(solvent casting and particulate leaching)[편집]
염침출법(solvent casting and particulate leaching, SCPL)은 규칙적인 다공성을 가진 구조물을 만들 수 있지만, 이 구조물의 두께는 제한되어 있다. 중합체를 적합한 유기용매에 녹이고(예: 폴리 락트산을 다이클로메탄(dichloromethane)에 용해시킬수 있음) 녹인 중합체를 적합한 기공유도물질(porogen) 주위에 캐스팅한다. 그리고 중합체를 건조하고 굳힌 후, 기공유도물질을 침출시켜 상호연결된 다공성 네트워크를 가진 중합체 스캐폴드를 만들 수 있다. 이러한 기공유도물질로 염화나트륨(sodium chloride)같은 무기 염, 사카로스 결정(crystals of saccharose), 젤라틴 구체(gelatin spheres), 파라핀 구체(paraffin spheres)가 사용된다. 다공성 스캐폴드는 기공유도물질의 제작 매개변수 및 유형, 양, 크기를 조정함으로써 맞춤 제작이 가능하다. 기공유도물질의 크기는 스캐폴드 기공의 크기에 영향을 미치는 반면, 중합체 대 기공유도물질 비율은 최종 구조의 다공성의 양과 직접적으로 관련된다. SCPL의 단점으로는 스캐폴드에 심어진 세포의 손상을 피하기 위해 사용되는 유기 용매를 완전히 제거해야 한다.
용융 성형법(melt molding)[편집]
입체 스캐폴드의 제조를 위한 다른 방법은 융용 성형법이다. 이 기술은 중합체와 기공유도물질 입자가 몰드에서 결합되어 중합체의 유리 전이 온도(비결정성 중합체의 경우) 또는 융용 온도(반 결정 중합체의 경우) 이상으로 가열되도록 요구한다. 중합체의 재구성 후, 복합 재료를 몰드로부터 꺼내어 냉각시키고, 적절한 액체에 침지시켜 유도물질입자를 침출시킨다. 생성된 다공성 스캐폴드는 틀과 동일한 외부 형상을 갖는다.
막 라미네이션(membrane lamination)[편집]
조직 공학은 종종 뼈와 연골과 같은 모양 의존적 기능을 가진 단단한 조직을 위해 정확한 3차원 해부 구조를 필요로 한다. melt molding으로 제조된 다공성 중합체의 얇은 층은 막 라미네이션에 의해 절단, 적층, 및 결합될 수 있다.[27] 층들은 화학적으로 결합되지만, 2개의 인접한 막의 경계면에는 뚜렷한 경계가 없다. 이 방법의 핵심은 원하는 스캐폴드 모양의 3차원 등고선도를 만드는 것이다. 스캐폴드의 각 층은 다공성 막에서 해당 레벨에 맞는 모양으로 절단된다. 클로로포름과 같은 소량의 용매가 계면 표면에 코딩되어 있고, 막 사이에 결합이 형성되어 있다. 이 과정은 최종 3차원 구조가 완성될 때까지 모든 후속 층에 대해 반복된다. 막 라미네이션에 사용되는 다공성 중합체는 SCPL에 의해 형성된 PLA 및 PLGA 막이 포함된다. 앞서 언급된 바와 같이 완성된 스캐폴드의 층들 사이에는 검출가능한 경계가 없다. 막 라미네이션은 개별적인 막과 동일한 벌크 특성을 갖는 3차원 해부학적 형태를 제조하는 방법을 제공한다.

압출법(extrusion)[편집]
조직공학을 위한 중합체의 첫번째 압출법은 PLGA 및 PLLA를 이용하여 말초신경 재생을 위한 관형 스캐폴드를 형성한 것이다.[28] 기공유도물질로 염화나트륨을 사용하여 solvent casting을 사용하여 중합체를 막으로 제조하였다. 제조된 막을 적절한 크기로 절단하고 맞춤형 압출 도구에 넣는다. 압출기는 복합 재료에 열과 압력을 가하고 노즐을 통해 원통형 도관을 형성하도록 압력을 가한다. 도관을 식힌 후, 물에 담가 염화나트륨을 침출하고 진공 건조시킨다. 온도가 높을수록 압력이 낮아지고 온도가 낮을수록 압력이 높아진다. 고압에는 강력한 유압 프레스가 필요할 수 있지만, 고온은 스캐폴드의 결정도 및 다공성, 혼입된 생체 분자의 활성에 악영향을 줄 수 있다. 압출법 또한, 다른 방법과 마찬가지로 기공유도물질 함량 및 크기는 다공성 및 평균 기공 직경의 가장 중요한 매개 변수이다. 압출된 중합체 스캐폴드는 세포의 이동 또는 조직 공학을 위한 성장인자를 지원하기 위해 제작할 수 있다.
동결 건조법(freeze-drying)[편집]
제어 가능한 다공성 및 평균 기공 직경을 가지는 스캐폴드의 신속한 제조를 위한 방법 중 하나이다. 중합체를 적절한 용매(예: 폴리 락트산을 다이클로메탄(dichloromethane)에 용해시킬수 있음)에 용해시킨 다음 물을 중합체 용액에 첨가하고 두 액체를 혼합하여 에멀젼을 얻는다.[29] 생성된 에멀젼을 몰드에 붓고 액체 질소로 동결시킨다. 동결 건조는 물과 용매를 제거하여 고도로 상호 연결된 기공, 최대 90%의 기공률 및 15~35um의 평균 기공 직경의 스캐폴드를 생성한다. 이 기술은 PGA, PLLA, PLGA 및 PPF(poly(propylene fumarate)를 포함한 많은 생체 적합성 중합체와 함께 사용되었다. 에멀젼과 동결 건조를 사용하는 방법은 SCPL처럼 고체 기공유도물질을 사용할 필요가 없다. 또한 SCPL처럼 시간이 많이 걸리는 침출 단계가 필요하지 않기 때문에 빠르게 준비되지만 여전히 용매를 사용해야 한다. 또한 만들어진 기공 크기가 작고 기공률이 종종 불규칙하다.
상 분리법(phase separation)[편집]
분해 가능한 조직 공학 스캐폴드로부터 약물과 다른 생체 활성 분자를 전달할 수 있는 가능성은 세포 분화를 조절하고 조직 재생을 유도하는데 유리하다. 이러한 스캐폴드는 생체 활성 분자를 유기 화학 물질이나 극한 온도에 노출시키지 않는 상 분리 기술에 의해 생성될 수 있다.[30] PLGA 또는 poly(phosphoester)와 같은 생체 적합성 중합체는 적절한 용매(예: 552°C에서 페놀, 63°C에서 다이옥산(dioxane), 85°C에서 나프탈렌)에 용해된다. 흔들어 섞는 동안, 생체 활성 분자를 균질 혼합물에 첨가되어 분산시키고, 액상이 분리될 때까지 용매 융점 미만으로 냉각시킨다.[31] 중합체 및 용매는 액체 질소로 급냉함으로써 2상 고체를 얻을 수 있다. 용매는 승화에 의해 제거하여, 중합체 내에 생체 활성 분자가 있는 다공성 스캐폴드를 생성한다. 다공성 및 구조는 중합체에 대한 용매의 냉각 속도 및 융용 온도에 의해 영향을 받는다. 특정 약물 방출 속도를 조정하고 큰 단백질을 포함시키는 것은 상 분리 방법에 있어 주요 장애물이다.
가스 포밍법(gas foaming)[편집]
SCPL에 대한 가장 큰 문제점은 유기 용매의 사용이다. 유기 용매의 잔류물은 주입 후 염증반응을 일으킬 수 있다. 이를 피하기 위해 가스 포밍법을 사용한다. 압축된 중합체 디스크(예: PLGA)는 고압 CO2로 처리된다. 압력은 점차 대기 수준으로 회복된다. 압력이 감소함에 따라, 압력의 양과 감소 속도에 따라 중합체 매트릭스에서 핵 형성 및 기공이 형성된다. 평균 긱홍 크기는 100um~500um의 범위이다.[32] 기공은 중합체를 떠나는 CO2분자에 의해 형성되어 스펀지형 구조를 생성한다. 이 기술의 주요 문제점은 압축 성형동안 사용된 과도한 열과 공극이 상호연결된 구조를 형성하지 않는다는 것이다.
펩타이드 자가 조립법(peptide self-assembly)[편집]
1990년대 중반 이후, 조직 공학 스캐폴드에서는 합성 ECM에서의 펩타이드 나노 섬유 사용을 연구한다. 콜라겐, 젤라틴 및 피브린과 같은 다른 생물학적 유래 물질은 합성 중합체와 비교하여 세포와 우호적으로 상호작용할 수 있지만, 펩타이드 섬유는 자가 조립되어 나노 규모에서 안정적이고, 고도로 정렬된 스캐폴드를 형성할 수 있다.[33] 자가 조립 펩타이드는 소수성 및 친수성 도메인을 번갈아 가지는 이온성 자가 상보적 서열로 구성된다.[34] 자가 조립 펩타이드 구조는 나노 규모에서 형성되며, 부착된 세포가 본래의 3차원 형태를 유지하게끔 하며, 일부 마이크로스케일 표면에 부착된 세포처럼 평평해지지 않을 수 있다. 아미노산 서열에서 하전된 소수성 잔기의 간격을 조절함으로써, 형성된 스캐폴드의 기하학적 구조가 조작될 수 있다. 펩타이드 분자 내부와 그 사이의 비공유 결합 및 이온 상호작용은 합성 생물학적 시스템에서 기능적 및 동적 구조를 생성한다. 인접한 섬유는 시스테인 잔기의 배치에 의해 이환화 결합으로 영구적으로 교차연결될 수 있다. 자가 조립 펩타이드는 물 또는 생리학적 용액에서 일반적으로 안정한 β-sheet를 형성한다. 양극성 펩타이드는 시트, 막대, 구, 디스크와 같이 더 복잡한 구조를 형성하는 것으로 나타났다. 스캐폴드 조립 및 크기는 pH, 펩타이드 농도, 2가 이온 유도에 의해 제어될 수 있다.
조직 배양[편집]
대다수의 경우에, 시험관 내(in vitro)에서 기능성 조직 및 생물학적 구조의 생성은 생존, 성장, 기능 유도를 촉진하기 위해 광범위한 배양이 필요하다. 일반적으로 세포는 산소, pH, 습도, 온도, 영양소 및 삼투압 유지를 포함한 배양 환경을 맞추어주어야 한다. 조직 공학적 배양은 배양 조건을 유지하는데 추가적인 문제가 있다. 표준 세포 배양에서 확산은 영양소 및 대사 산물 수송의 유일한 수단이다. 그러나, 조작된 기관 및 전체 조직의 경우와 같이 배양물이 더 크고 복잡해지면, 조직 내에 모세관 네트워크의 생성과 같은 다른 메커니즘을 함께 사용하여 배양물을 유지해야 한다. 조직 배양으 또 다른 문제는 기능을 유도하는데 필요한 적절한 인자 및 자극을 도입하는 것이다. 대부분의 경우, 간단한 배양 방법(유지하는 것 등)으로는 충분하지 않다. 성장 인자, 호르몬, 특정 대사 산물 또는 영양소, 화학적 및 물리적 자극이 종종 요구된다. 예를 들어, 골격 발달(skeletal development) 중 낮은 산소 환경이나 저산소에 적응해야 하는 연골세포(chondrocytes)와 같이, 정상적인 발달과정 중 일부로서 산소 장력의 변화에 반응해야 한다. 내피세포(endothelial cell)와 같은 다른 세포들은 혈관에서 마주치는 유체 흐름으로 인한 절단(shear) 스트레스에 반응한다. 압력 펄스와 같은 기계적 자극은 심장 판막, 혈관 또는 심낭과 같은 모든 종류의 심혈관 조직에 이로운 것으로 보인다.
생물반응기(Bioreactor)[편집]

생물반응기 혹은 생체반응기라고도 한다. 조직 공학에서의 생물반응기는 시험관 내에서(in vitro)에서 세포 또는 조직 성장을 촉진시키기 위해 생리학적 환경을 시뮬레이션하는 장치이다. 생리학적 환경은 온도 및 산소 또는 이산화탄소 농도와 같은 다양한 매개 변수로 구성될 수 있지만 모든 종류의 생물학적, 화학적 또는 기계적 자극으로 넓혀질 수도 있다. 따라서, 2차원 또는 3차원 환경에서 조직에 힘 또는 응력, 심지어 전류의 힘도 포함할 수 있는 시스템이다.
학술 및 산업 연구 시설에서, 생물반응기는 성장 중인 조직의 특정 생리적 환경을 복제하도록 개발되는 것이 일반적이다(예: 심장 조직 성장을 위한 유동성있는 전단)[35]. 여러 일반 용도와 응용 분야별 생물반응기도 상업적으로 사용할 수 있으며, 정적 화학 자극 또는 화학적 및 기계적 자극의 조합을 제공할 수 있다.
3D 세포 배양을 위해 만들어진 다양한 생물반응기가 존재한다. 작은 플라스틱 원통형 챔버와 유리 챔버가 있으며, 내부 습도와 수분이 조절되어 세포를 3차원으로 성장시키기 위해 특별히 설계되었다.[36] 생물반응기는 폴리에틸렌테레프탈레이트(polyethylene terephthalate) 막과 같은 생물 활성 합성 물질을 사용하여 높은 수준의 영양분을 유지하는 환경에서 스페로이드 세포들을 둘러싼다.[37] 이들은 쉽게 열고 닫을 수 있어 테스트를 위해 스페로이드를 제거할 수 있지만, 챔버는 100% 습도를 유지할 수 있다.[38] 이 습도는 최대 세포 성장 및 기능을 달성하는데 중요하다. 생물반응기 챔버는 3차원에 걸쳐 각 방향에서 균일한 세포 성장을 보장하기 위해 회전하는 더 큰 장치의 일부이다.[38]
현재 싱가포르 Quintech Life Sciences가 운영하는 QuinXell Technologies는 조직 공학을 목적으로 만들어진 TisXell Biaxial Bioreactor로 알려진 생물반응기를 개발했다. 이는 세계 최초로 양축 회전이 있는 구형 유리 챔버를 가진 생물 반응기로, 특히 자궁 내 태아의 회전을 모방하기 위한 것이며, 이것은 조직의 성장에 도움이 되는 환경을 제공한다.[39]
MC2 Biotek은 가스 교환을 사용하여 세포실 내에서 높은 산소 수준을 유지하는 ProtoTissue[36]로 알려진 생물반응기를 개발했다. 산소 수준이 높을수록 세포가 성장하고 정상적인 세포 호흡을 할 수 있다는 점이 이전의 생물반응기보다 향상된 점이다.
장섬유 생성(long fiber generation)[편집]
2013년, 도쿄 대학교에서 최대 1m 길이, 100μm 크기의 세포 적제 섬유를 개발했다.[40] 이 섬유는 이중 동축 층류 흐름을 형성하는 미세 유체 장치를 사용하여 만들어졌다. 미세 유체 장치의 각 '층'은 ECM, 하이드로겔 피복, 최종적으로 염화칼슘 용액에 심어진 세포들이다. 하이드로겔 피복 안에 심어진 세포는 며칠동안 배양된 후, 이 피복은 살아남은 세포 섬유로 제거된다. ECM core에 삽입되는 세포의 종류는 다양하며, 근세포(myocytes), 내피 세포(endothelial cells), 신경 세포 섬유(nerve cell fibers), 상피 세포 섬유(epithelial cell fibers)가 있다. 이 그룹들은 섬유를 짜는 것과 유사한 메커니즘으로 조직이나 기관을 제작하기 위해 섬유가 함께 만들어질 수 있음을 보여주었다. 섬유질 형태는 전통적인 스캐폴드 디자인에 대한 대안을 제공한다는 점과 근육을 비롯한 많은 기관이 섬유질 세포로 구성되어 있다는 것이 하나의 장점이다.
생체 인공 기관(Bioartificial organ)[편집]
인공 장기란, 인간이 인공 장기를 대체하기 위해 인간에게 이식되거나 통합된 인공 장치로, 특정 기능이나 관련 기능을 복원하여 환자가 최대한 빨리 정상적인 생활로 돌아올 수 있도록 한다. 교체된 기능이 반드시 생명 유지와 관련이 있을 필요는 없지만 종종 관련이 있기도 하다. 조직 공학의 궁극적인 목표는 '특별히 주문하거나 디자인 하지 않아도 되는 기성'의 생체 인공 기관과 신체의 손상된 조직 재생을 허용하는 것이다. 환자 줄기 세포로부터 생체 인공 기관을 성공적으로 생성하기 위해, 연구자들은 조직 공학에 의한 복합 조직의 생성을 지속적으로 개선하고 있다. 예를 들어, 세포의 미세 환경에 존재하는 나노 규모 신호를 이해하기 위한 많은 연구가 이루어지고 있다.[41]
생체 모방 기술(Biomimetics)[편집]
생체 모방 기술은 자연에 존재하는 것들을 복제하는 물질 및 시스템을 생산하는 것을 목표로 하는 분야이다.[42] 조직 공학의 맥락에서, 이것은 엔지니어가 구조, 특성 및 생체 적합성 측면에서 본래의 조직에 필적하는 재료를 만들기 위해 사용하는 일반적인 접근 방식이다. 재료의 특성은 해당 재료의 물리적, 구조적 및 화학적 성질에 크게 좌우된다. 결과적으로 시스템 설계에 대한 생체 모방적 접근 방식은 재료를 합치는 과정에서 중요해질 것이며, 생물학적 과정과 상호작용에 대한 충분한 이해가 필요할 것이다. 생물학적 시스템 및 공정의 복제는 생물학적 재료를 만들기 위한 상태를 위해 생체 자극 물질의 합성에 사용될 수도 있다. 따라서, 구조적·화학적으로 생체 조직과 동일한 특성을 가진 물질이 합성된다면, 이 물질은 생체 조직과 유사한 성질을 가질 것이다. 이 기술은 인간의 문제에 대한 해답으로 자연 현상에서 해답을 찾는다는 아이디어에서 시작된 광범위한 역사를 가지고 있다. 항공기, 자동차, 건축, 심지어 산업 시스템을 포함한 것들이 자연계에서 영감을 받아 기술을 발전을 이룬 것이다. 나노 기술의 발전으로 이 기술을 조직 공학을 포함한 마이크로 및 나노 스케일 문제에 적용하기 시작했고. 합성 뼈 조직, 혈관 기술, 스캐폴딩 재료 및 통합 기술, 나노 입자를 개발하는데 사용되었다.[42]
각주[편집]
- ↑ 가 나 “:: 서울대학교 줄기세포 및 조직공학 연구실 ::”. 2020년 4월 20일에 확인함.
- ↑ Whitney G. A.; Jayaraman K.; Dennis J. E.; Mansour J. M. (2014). “Scaffold-free cartilage subjected to frictional shear stress demonstrates damage by cracking and surface peeling”. 《J Tissue Eng Regen Med.》. doi:10.1002/term.1925.
- ↑ “Langer Lab: Professor Robert Langer”.
- ↑ “The Laboratory for Tissue Engineering and Organ Fabrication - Massachusetts General Hospital, Boston, MA”. 2016년 12월 1일에 원본 문서에서 보존된 문서. 2017년 1월 19일에 확인함.
- ↑ Langer R; Vacanti JP (May 1993). “Tissue engineering”. 《Science》 260 (5110): 920–6. Bibcode:1993Sci...260..920L. doi:10.1126/science.8493529. PMID 8493529.
- ↑ 가 나 MacArthur BD; Oreffo RO (January 2005). “Bridging the gap”. 《Nature》 433 (7021): 19. Bibcode:2005Natur.433...19M. doi:10.1038/433019a. PMID 15635390.
- ↑ 《Principles of tissue engineering》 3판. Amsterdam: Elsevier Academic Press. 2007. 4쪽. ISBN 978-0-08-054884-5.
- ↑ 가 나 다 Kim, Woo Seob (2014). “The principles of tissue engineering and its recent advances and future prospects”. 《Journal of the Korean Medical Association》 57 (2): 145. doi:10.5124/jkma.2014.57.2.145. ISSN 1975-8456.
- ↑ 가 나 《Principles of tissue engineering》 3판. Amsterdam: Elsevier Academic Press. 2007. 8-9쪽. ISBN 978-0-08-054884-5.
- ↑ Mashayekhan, Shohreh; Hajiabbas, Maryam; Fallah, Ali (2013년 8월 28일). Bhartiya, Deepa, 편집. 《Stem Cells in Tissue Engineering》 (영어). InTech. doi:10.5772/54371. ISBN 978-953-51-1192-4.
- ↑ 가 나 O'Brien, Fergal J. (2011년 3월 1일). “Biomaterials & scaffolds for tissue engineering”. 《Materials Today》 (영어) 14 (3): 88–95. doi:10.1016/S1369-7021(11)70058-X. ISSN 1369-7021.
- ↑ 가 나 Chan, B. P.; Leong, K. W. (2008년 12월). “Scaffolding in tissue engineering: general approaches and tissue-specific considerations”. 《European Spine Journal》 (영어) 17 (S4): 467–479. doi:10.1007/s00586-008-0745-3. ISSN 0940-6719. PMC 2587658. PMID 19005702.
- ↑ Babensee, Julia E.; Anderson, James M.; McIntire, Larry V.; Mikos, Antonios G. (1998년 8월 3일). “Host response to tissue engineered devices”. 《Advanced Drug Delivery Reviews》. Tissue Engineering (영어) 33 (1): 111–139. doi:10.1016/S0169-409X(98)00023-4. ISSN 0169-409X.
- ↑ Wang, Qun. ([2017]). 《Smart materials for tissue engineering : fundamental principles》. Royal Society of Chemistry. ISBN 978-1-78262-675-6.
- ↑ Lopes, M. Savioli; Jardini, A. L.; Filho, R. Maciel (2012년 1월 1일). “Poly (Lactic Acid) Production for Tissue Engineering Applications”. 《Procedia Engineering》. CHISA 2012 (영어) 42: 1402–1413. doi:10.1016/j.proeng.2012.07.534. ISSN 1877-7058.
- ↑ Zhao, Xiaojun; Zhang, Shuguang; Spirio, Lisa (2005년 8월 19일). 《PuraMatrix》. CRC Press. 217–238쪽. ISBN 978-1-57444-521-3.
- ↑ Chu, Constance R.; Coutts, Richard D.; Yoshioka, Makoto; Harwood, Frederick L.; Monosov, Anna Z.; Amiel, David (1995년 9월). “Articular cartilage repair using allogeneic perichondrocyteseeded biodegradable porous polylactic acid (PLA): A tissue-engineering study”. 《Journal of Biomedical Materials Research》 (영어) 29 (9): 1147–1154. doi:10.1002/jbm.820290915. ISSN 0021-9304.
- ↑ Wong, Wai Hung; Mooney, David J. (1997). 《Synthesis and Properties of Biodegradable Polymers Used as Synthetic Matrices for Tissue Engineering》. Boston, MA: Birkhäuser Boston. 51–82쪽. ISBN 978-1-4612-8677-6.
- ↑ Sun, Hongfan; Mei, Lin; Song, Cunxian; Cui, Xiumin; Wang, Pengyan (2006년 3월). “The in vivo degradation, absorption and excretion of PCL-based implant”. 《Biomaterials》 27 (9): 1735–1740. doi:10.1016/j.biomaterials.2005.09.019. ISSN 0142-9612.
- ↑ Hajiali, Faezeh; Tajbakhsh, Saeid; Shojaei, Akbar (2017년 6월 28일). “Fabrication and Properties of Polycaprolactone Composites Containing Calcium Phosphate-Based Ceramics and Bioactive Glasses in Bone Tissue Engineering: A Review”. 《Polymer Reviews》 58 (1): 164–207. doi:10.1080/15583724.2017.1332640. ISSN 1558-3724.
- ↑ Wang, Jin-Yang; Wang, Kai; Gu, Xi; Luo, Ying (2016년 6월 13일). “Polymerization of Hydrogel Network on Microfiber Surface: Synthesis of Hybrid Water-Absorbing Matrices for Biomedical Applications”. 《ACS Biomaterials Science & Engineering》 2 (6): 887–892. doi:10.1021/acsbiomaterials.6b00143.
- ↑ Ivkovic, Alan (2011). “Regenerative medicine and tissue engineering in orthopaedic surgery”. 《Frontiers in Bioscience》 (영어) E3 (3): 923–944. doi:10.2741/e299. ISSN 1945-0494.
- ↑ 《Principles of tissue engineering》 3판. Amsterdam: Elsevier Academic Press. 2007. ISBN 978-0-08-054884-5.
- ↑ Mikos, Antonios G.; Bao, Yuan; Cima, Linda G.; Ingber, Donald E.; Vacanti, Joseph P.; Langer, Robert (1993년 2월). “Preparation of poly(glycolic acid) bonded fiber structures for cell attachment and transplantation”. 《Journal of Biomedical Materials Research》 (영어) 27 (2): 183–189. doi:10.1002/jbm.820270207. ISSN 0021-9304.
- ↑ Mooney, D. J.; Sano, K.; Kaufmann, P. M.; McNamara, K.; Vacanti, J. P.; Langer, R. (1995). “Integrating Cell Transplantation and Controlled Drug Delivery Technologies to Engineer Liver Tissue”. 《MRS Proceedings》 385. doi:10.1557/proc-385-43. ISSN 0272-9172.
- ↑ Yoshimoto, H.; Shin, Y.M.; Terai, H.; Vacanti, J.P. (2003년 5월). “A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering”. 《Biomaterials》 24 (12): 2077–2082. doi:10.1016/s0142-9612(02)00635-x. ISSN 0142-9612.
- ↑ Mikos, Antonios G.; Sarakinos, Georgios; Leite, Susan M.; Vacant, Joseph P.; Langer, Robert (1993년 4월). “Laminated three-dimensional biodegradable foams for use in tissue engineering”. 《Biomaterials》 (영어) 14 (5): 323–330. doi:10.1016/0142-9612(93)90049-8.
- ↑ Widmer, Markus S.; Gupta, Puneet K.; Lu, Lichun; Meszlenyi, Rudolf K.; Evans, Gregory R.D.; Brandt, Keith; Savel, Tom; Gurlek, Ali; Patrick, Charles W. (1998년 11월). “Manufacture of porous biodegradable polymer conduits by an extrusion process for guided tissue regeneration”. 《Biomaterials》 19 (21): 1945–1955. doi:10.1016/s0142-9612(98)00099-4. ISSN 0142-9612.
- ↑ Whang, K.; Thomas, C.H.; Healy, K.E.; Nuber, G. (1995년 1월). “A novel method to fabricate bioabsorbable scaffolds”. 《Polymer》 36 (4): 837–842. doi:10.1016/0032-3861(95)93115-3. ISSN 0032-3861.
- ↑ Lo, H.; Ponticiello, M.S.; Leong, K.W. (1995년 3월). “Fabrication of Controlled Release Biodegradable Foams by Phase Separation”. 《Tissue Engineering》 1 (1): 15–28. doi:10.1089/ten.1995.1.15. ISSN 1076-3279.
- ↑ Hua, Feng Jun; Kim, Go Eun; Lee, Jong Doo; Son, Yong Keun; Lee, Doo Sung (2002). “Macroporous poly(L-lactide) scaffold 1. Preparation of a macroporous scaffold by liquid-liquid phase separation of a PLLA-dioxane-water system”. 《Journal of Biomedical Materials Research》 63 (2): 161–167. doi:10.1002/jbm.10121. ISSN 0021-9304.
- ↑ Mooney, David J.; Baldwin, Daniel F.; Suh, Nam P.; Vacanti, Joseph P.; Langer, Robert (1996년 7월 1일). “Novel approach to fabricate porous sponges of poly(d,l-lactic-co-glycolic acid) without the use of organic solvents”. 《Biomaterials》 (영어) 17 (14): 1417–1422. doi:10.1016/0142-9612(96)87284-X. ISSN 0142-9612.
- ↑ Yokoi, H.; Kinoshita, T.; Zhang, S. (2005년 6월 14일). “Dynamic reassembly of peptide RADA16 nanofiber scaffold”. 《Proceedings of the National Academy of Sciences》 (영어) 102 (24): 8414–8419. doi:10.1073/pnas.0407843102. ISSN 0027-8424. PMC 1150805. PMID 15939888.
- ↑ Zhang, Shuguang; Holmes, Todd C.; DiPersio, C.Michael; Hynes, Richard O.; Su, Xing; Rich, Alexander (1995년 12월). “Self-complementary oligopeptide matrices support mammalian cell attachment”. 《Biomaterials》 (영어) 16 (18): 1385–1393. doi:10.1016/0142-9612(95)96874-Y.
- ↑ Lee, Elaine L.; von Recum, Horst A. (2010). “Cell culture platform with mechanical conditioning and nondamaging cellular detachment”. 《Journal of Biomedical Materials Research Part A》 (영어). 9999A: NA–NA. doi:10.1002/jbm.a.32754.
- ↑ 가 나 “MC2 Biotek | 3D Tissue Culture | The 3D ProtoTissue System™”. 2012년 5월 28일. 2012년 5월 28일에 원본 문서에서 보존된 문서. 2020년 6월 16일에 확인함.
- ↑ Friedrich, Juergen; Seidel, Claudia; Ebner, Reinhard; Kunz-Schughart, Leoni A (2009년 3월). “Spheroid-based drug screen: considerations and practical approach”. 《Nature Protocols》 (영어) 4 (3): 309–324. doi:10.1038/nprot.2008.226. ISSN 1754-2189.
- ↑ 가 나 Marx, Vivien (2013년 4월). “A better brew”. 《Nature》 496 (7444): 253–258. doi:10.1038/496253a. ISSN 0028-0836.
- ↑ Zhang, Zhi-Yong; Teoh, Swee Hin; Chong, Woon-Shin; Foo, Toon-Tien; Chng, Yhee-Cheng; Choolani, Mahesh; Chan, Jerry (2009년 5월). “A biaxial rotating bioreactor for the culture of fetal mesenchymal stem cells for bone tissue engineering”. 《Biomaterials》 (영어) 30 (14): 2694–2704. doi:10.1016/j.biomaterials.2009.01.028.
- ↑ Onoe, Hiroaki; Okitsu, Teru; Itou, Akane; Kato-Negishi, Midori; Gojo, Riho; Kiriya, Daisuke; Sato, Koji; Miura, Shigenori; Iwanaga, Shintaroh (2013년 3월 31일). “Metre-long cell-laden microfibres exhibit tissue morphologies and functions”. 《Nature Materials》 12 (6): 584–590. doi:10.1038/nmat3606. ISSN 1476-1122.
- ↑ Cassidy, John W. (2014년 1월). “Nanotechnology in the Regeneration of Complex Tissues”. 《Bone and Tissue Regeneration Insights》 5: BTRI.S12331. doi:10.4137/btri.s12331. ISSN 1179-061X.
- ↑ 가 나 Choi, Jonghoon; Hwang, Jangsun; Jeong, Yoon; Park, Jeong Min; Lee, Kwan Hong; Hong, Jong Wook (2015년 9월). “Biomimetics: forecasting the future of science, engineering, and medicine”. 《International Journal of Nanomedicine》 (영어): 5701. doi:10.2147/IJN.S83642. ISSN 1178-2013. PMC 4572716. PMID 26388692.
