비뉴클레오사이드 역전사효소 억제제의 발견과 발전
비뉴클레오사이드 역전사 효소 억제제들(NNRTIs)은 인간 면역 결핍 바이러스 (HIV) 치료에 사용되는 항 레트로 바이러스 약물이다. NNRTIs는 HIV 유전 물질 복제를 조절하는 역전사 효소(RT)를 억제한다. RT는 항 레트로 바이러스 약물 개발 분야에서 가장 인기 있는 표적 중 하나이다.[1] NNRTIs 발견과 개발은 1980년대 후반에 시작되었고[2] 2009년 말에 4개의 NNRTI가 규제 당국의 승인을 받았으며 다른 여러 NNRTI의 임상 개발을 진행하였다. NNRTIs를 단일 요법으로 투여 시 약물 내성이 빠르게 발현되므로 항상 고활성 항 레트로 바이러스 요법(HAART)인 복합 요법의 일부로 사용된다.[3]
역사[편집]
후천성 면역 결핍 증후군(AIDS)은 전 세계 주요 사망 원인이다. AIDS는 1981년에 질병으로 확인되었다. 2년 후 AIDS의 병인인 HIV가 설명되었다.[4] HIV는 레트로 바이러스이며 HIV-1, HIV-2의 2가지 주요 혈청 형을 가진다. 대유행은 대부분 HIV-1이 관련된 반면 HIV-2는 낮은 이환률을 가지며 주로 서아프리카로 제한된다.[5] 2009년 한 해 동안 전 세계적으로 4천만 명이 넘는 사람들이 HIV에 감염되었고 그 수는 계속 증가하고 있다.[6] 감염된 개인의 대다수는 개발 도상국에 살고 있다.[7] HIV 약물은 HIV 감염을 치료하지 않지만 환자의 삶의 질을 개선하고 사망률을 줄이는 것을 치료 목표로 한다.[8] 2009년에 HIV 감염 치료를 위해 25개의 항 레트로 바이러스 약물을 사용할 수 있었다. 약물들은 6개의 클래스에 속하며 이들은 각각 서로 다른 표적에 작용한다.[1] 항 레트로 바이러스 약물 개발 분야에서 가장 널리 사용되는 표적은 HIV-1 역전사 효소 (RT) 효소이다. HIV-1 RT 효소를 표적으로 하는 약물에는 뉴클레오사이드 / 뉴클레오타이드 역전사 효소 억제제 (NRTI / NtRTI) 그리고 비뉴클레오사이드 역전사 효소 억제제 (NNRTI)로 2가지 종류가 있다. 이러한 종류의 약물은 HAART로 더 잘 알려진 고 활성 항 레트로 바이러스 요법인 HIV 복합 요법의 중요한 구성 요소이다.[3] 1987년에 HIV 감염 치료를 위한 최초의 약물이 미국 식품의약국 (FDA)의 승인을 받았다. 이것은 지도부딘(Zidobudoin)이라고 불리는 NRTI이다. 1980년대 후반에, NRTI의 추가 개발 과정에서 NNRTI 발견 분야가 시작되었다. NNRTI의 개발은 1990년대 빠르게 개선되며 곧 프로테아제 억제제(protease inhibitors)에 이어 세 번째 종류의 항 레트로 바이러스 약물이 되었다.[7][8] NNRTI는 HIV-1 특이적이며 HIV-2 및 기타 레트로 바이러스들에 대해선 반응이 없다. 최초의 NNRTI인 네비라핀(nevirapine)은 Boehringer Ingelheim의 연구자들에 의해 발견되었으며 1996년 FDA의 승인을 받았다. 이후 2년 동안 두 개의 다른 NNRTI, 1997년에 델라비르딘(delavirdine)과 1998년에 에파비렌즈(efavirenz)가 승인되었다. 이 세 가지 약물이 1세대 NNRTI이다. 더 나은 내성 프로파일을 가진 NNRTI의 필요성은 차세대 NNRTI의 개발로 이어졌다. Janssens Foundation과 Tibotec의 연구원들은 2008년 FDA 승인을 받은 차세대 NNRTI 첫 번째 약물인 에트라비린(etravirine)을 발견했다. 이 등급의 두 번째 약물인 릴피비린(rilpivirine)은 Tibotec에 의해 발견되었으며 2011년 FDA 승인을 받았다. 이외에도 몇 가지 다른 약물이 임상 개발 중에 있다.[7]
HIV-1 역전사 효소[편집]
기능[편집]
역전사 효소(RT)는 HIV 그리고 기타 레트로 바이러스의 유전 물질 복제를 제어하는 효소이다.[1] 이 효소에는 2가지 기능이 있다. 첫째, 단일 가닥 RNA 게놈을 단일 가닥 DNA로 전사한 후 상보적인 DNA 가닥을 만드는 중합 효소 역할을 한다. 이것은 숙주 세포의 염색체에 끼어들 수 있는 DNA 이중 나선을 제공한다.[7] 둘째, 바이러스 DNA 합성 중에 형성되는 RNA-DNA 중간체의 RNA 가닥을 분해하므로 리보뉴클레이스 H (Rnase H) 활성이 있다.[9]
구조[편집]
HIV-1 RT는 p66 (560개 아미노산)과 p51(440개 아미노산) 서브 유닛으로 구성된 비대칭 1000개 아미노산 이종 이량체이다.[1] p66 서브 유닛에는 중합 효소와 리보뉴클레이스 H 두 개의 도메인이 있다. 중합 효소 도메인은 "손가락", "손바닥", "엄지 손가락" 그리고 "연결"이라고 하는 4개의 하위 도메인을 포함하며 종종 오른손과 비교된다 (그림 1).[7] p66 서브 유닛의 역할은 RT의 활성을 수행하는 반면 효소의 활성 부위를 포함한다. p51은 주로 구조적 역할을 하는 것으로 예상된다.[9]
결합 및 약물단[편집]
NNRTI의 화학적 다양성에도 불구하고 모두 RT의 동일한 위치에서 결합한다. 결합은 효소의 p66 서브 유닛 부위의 손바닥 도메인에 있는 촉매 부위에서 약 10Å에 위치한 소수성 포켓에서 알로스테리적으로 일어난다.[1][7] NNRTI 결합 포켓(NNIBP)은 p66 서브 유닛에 속하는 5개의 방향족 (Tyr-181, Tyr-188, Phe-227, Trp-229)과 6개의 소수성 (Pro-59, Leu-100, Val-106, Val-179, Leu-234, Pro-236) 그리고 5개의 친수성 (Lys-101, Lys-103, Ser-105, Asp-132 및 Glu-224) 아미노산을 포함하고 p51 서브 유닛에 속하는 2개의 아미노산 (Ile-135 및 Glu-138)을 포함한다.[7] 각 NNRTI는 NNIBP의 다른 아미노산 잔기와 상호 작용한다.[10]
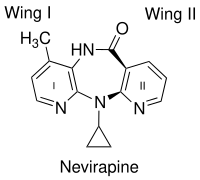
네비라핀(nevirapine)과 같은 1세대 NNRTI의 결합에서 중요한 요소는 나비 모양이다. 화학적 다양성에도 불구하고 그들은 매우 유사한 나비 모양을 가진다.[10] NNRTI의 두 개의 방향족 고리가 효소 내에서 나비의 날개를 닮았다 (그림 2). 나비 구조의 몸체는 친수성 중심을 가지고 날개를 나타내는 두 개의 소수성 부분을 가지고 있다.[11] 날개 I은 일반적으로 헤테로 방향족 고리이고 날개 II는 페닐 또는 알릴 치환기이다. 날개 I은 고리의 한쪽에 아미노산 Lys-101 그리고 Lys-103의 주쇄와 수소 결합을 수용 그리고/또는 공여할 수 있는 작용기를 가지고 있다. Wing II는 π-π 상호 작용을 통해 소수성 포켓과 상호 작용하며, 대부분 방향족 아미노산의 측쇄에 의해 형성된다. 나비 몸체에서 소수성 부분은 주로 Lys-103, Val-106 그리고 Val-179의 측쇄로 형성된 작은 주머니를 채운다.[12] 그러나 다른 많은 NNRTI가 다른 모드에서 RT에 바인딩하는 것으로 밝혀졌다. diarylpyrimidins(DAPY)과 같은 2세대 NNRTI는 2개의 측면 소수성 날개와 중심 극성 부분인 피리미딘 링을 가진 말발굽과 같은 모양을 가지고 있다.[13]
NNIBP는 탄력적이며 형태는 NNRTI의 크기, 특정 화학 성분 그리고 결합 모드에 의존한다. RT의 전체 구조는 결합된 NNRTI의 특성에 따라 부분적 유연성을 가진다. 억제제가 돌연변이 표적의 변형된 포켓에 결합할 수 있는 유연성을 갖는 것은 중요하다. 억제제 유연성은 억제제-표적 상호 작용에 영향을 미치지 않을 수 있다.[10]
작용 메커니즘[편집]
NNRTI는 RT 효소에 비경쟁적으로 결합하여 작용한다 (그림 3). 결합은 효소의 3차원 구조에 구조적 변화를 일으키고 NNIBP를 생성한다.[6][7]HIV-1 RT에 NNRTI의 결합은 아미노산 Tyr-181 그리고 Tyr-188 잔기에서 회전이성질체 형태 변화를 유도해 p66 엄지 도메인을 과도하게 확장시킨다.[14] 이것은 효소의 촉매 활성에 영향을 미치고 RT의 p66 서브 유닛의 중합 효소 활성 부위를 억제함으로써 HIV-1 복제를 차단한다.[15] 전체적인 구조적 변화는 핵산 주형의 효소를 추가적으로 불안정하게 하고 뉴클레오타이드에 결합하는 능력을 감소시킨다.[16] 바이러스의 RNA 전사가 억제되므로 바이러스의 복제 속도가 감소한다.[6]
이런 제안된 주요 작용 메커니즘에 더불어 NNRTI는 다른 작용 메커니즘을 갖고 역전사효소 반응의 다양한 단계를 방해하는 것으로 나타났다.[7]
차세대 NNRTI를 개발하고 약물 내성 메커니즘을 이해하기 위해서는 NNRTI의 다양한 작용 메커니즘에 대한 깊은 이해를 얻는 것이 중요하다.[15]
약물 발견 및 설계[편집]
효과적인 항 HIV 약물의 개발은 뉴클레오티드와 아미노산 염기서열의 다양성 때문에 어렵다.완벽한 항 HIV 약물은 약물 내성 돌연변이에 효과적이어야 한다. 표적 RT 효소와 그것의 구조, 약물 작용 메커니즘 및 약물 내성 돌연변이의 결과를 이해하는 것은 보다 효과적인 NNRTI 설계에 도움이 될 수 있는 유용한 정보를 제공한다. RT 효소는 NNRTI 결합을 방해할 수 있는 돌연변이로 인해 변화를 겪을 수 있다.[10]
발견[편집]
NNRTI로 확인된 처음 두 종류의 화합물은 1-(2-2-하이드록시에톡시메틸)-6-(페닐싸이오)티민(HEPT) 그리고 테트라하이드로이미다조[4,5,1-jkj][1,4]벤조다이아제핀- 2(1H)-온 및 -싸이온(TIBO)이다. TIBO 화합물이 발견됨에 따라 1980년대 후반에 NNRTI 등급의 정의가 이루어졌으며, 이때 예기치 않게 RT를 억제하는 것으로 밝혀졌다.[2] 이 발견은 이 화합물들의 작용 메커니즘에 대한 연구를 시작하게 했다. HEPT 화합물은 TIBO 화합물 이전에 설명되었으며 원래 NRTI로 추정되었다. 나중에 그들이 TIBO 화합물과 공통 작용 메커니즘을 공유했다는 것이 밝혀졌다.[4][7] HEPT와 TIBO 화합물은 다른 RT에 대해서는 활성화되지 않는 매우 특이적이고 강력한 HIV-1RT 억제제로 확인되었다.[4] 이 화합물들은 세포나 미토콘드리아 DNA 합성을 방해하지 않는다. HIV-1에 대한 NNRTI의 특이성은 NNRTI 약물 클래스의 특징으로 간주된다.[7]
개발[편집]
1세대 NNRTIs[편집]
HEPT와 TIBO가 발견된 후 화합물 스크리닝 방법을 사용하여 일반적으로 네비라핀으로 알려진 최초의 NNRTI인 BI-RG-587을 개발했다. HEPT, TIBO와 마찬가지로 네비라핀은 비경쟁적 억제(dNTP 결합과 관련)에 의해 바이러스 RT 활동을 차단했다. 이것은 새로운 종류의 항 HIV 억제제가 RT의 활성을 억제하지만 활성 부위를 억제하지 않는다는 생각을 강화했다. NNRTI의 몇몇 분자군은 많은 분자의 스크리닝과 진화 후에 나타났다.[8]
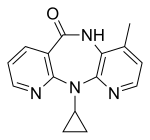
1세대의 세 가지 NNRTI 화합물은 HIV-1 감염 치료를 위해 미국 식품의약국 (FDA)의 승인을 받았다. 네비라핀은 1996년에 승인되었고, 델라비르딘은 1997년에, 그리고 에파비렌즈는 1998년에 승인되었다 (표 1). 이러한 약물 중 네비라핀과 에파비렌즈 두 가지는 1차 HAART의 초석이고 델라비르딘은 현재 거의 사용되지 않는다.[7][8] 이 세 가지 약물의 구조는 HIV-1 RT에 대한 활성을 허용하는 다양한 고리, 치환기 그리고 결합을 보여준다. 이러한 다양성은 왜 그렇게 많은 비뉴클레오사이드가 합성되었는지 보여주지만 왜 세 가지 약물만 시장에 출시되었는지는 설명하지 못한다. 주요 문제는 이러한 화합물의 내성을 발달시키는 능력이다.[8]
|
|

|
|---|---|---|
| 네비라핀 | 델라비르딘 | 에파비렌즈 |
α-APA에서 ITU로의 개발[편집]
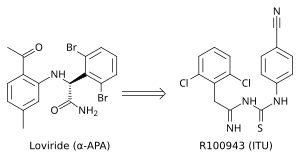
결정 구조 분석은 1세대 NNRTI(예: TIBO, 네비라핀 그리고 α-APA)가 "나비 같은" 형태로 HIV-1 RT에 결합하는 것으로 나타났다. 이 1세대 NNRTI는 Tyr-181C 및 Tyr-188L/H와 같은 일반적인 약물 내성 돌연변이에 취약했다. 이것은 새롭고 더 효과적인 NNRTI를 찾아야 할 필요성을 제기했다. 유망한 NNRTI 시리즈인 ITU(imidoylthiourea)는 α-APA 유사체에서 나왔다(그림 4). ITU 화합물은 α-APA의 아릴 사이드 그룹을 결합하는 링커를 확장하여 얻었다. 강력한 ITU 화합물인 R100943은 구조-활성 관계(SAR)을 기반으로 하는 사이드 그룹의 화학적 조성을 배열하여 얻었다. HIV-1/R100943 복합체의 결정 구조는 ITU 화합물이 α-APA 화합물보다 더 유연함을 증명했다. ITU 화합물은 "말굽" 또는 "U" 모드로 결합하는 뚜렷한 결합 모드를 보여주었다.
α-APA의 날개 II, 6-다이브로모페닐 부분과 화학적으로 일치하는 R100943의 2,6-다이클로로페닐 부분이 NNIBP의 날개 I 부분을 점유하는 반면 R100943의 4-시아노아닐리노 부분은 NNIBP(비뉴클레오사이드 억제제 결합 포켓)의 날개 II 부분을 차지한다.[10][17]
R100943은 HIV-1을 억제했으며, 로비라이드(α-APA) 및 네비라핀에 대한 높은 수준의 내성을 유발한 G190A 돌연변이와 같은 다수의 주요 NNRTI 내성 돌연변이에 대해 상당히 효과적이었다. G190A 돌연변이는 나비 모양의 NNRTI의 연결 부분에 의해 채워지는 결합 포켓의 일부를 점유함으로써 저항을 유발하는 것으로 생각되었다. 말굽형 결합모드에서 R100943은 G190에서 약 6.0Å의 거리에 있다. 나비 모양으로 결합하는 네비라핀 및 로비라이드와 비교할 때 ITU 파생 모델은 Tyr-181C 및 Tyr-188L 돌연변이에 대한 활성도가 개선되었다. 구조 연구는 잠재적 TIBO 화합물이 돌연변이 RT의 NNIBP(비뉴클레오사이드 억제제 결합 포켓)에서 스스로 이동함으로써 Tir-181C 돌연변이의 영향을 부분적으로 보완할 수 있음을 시사했다. 이러한 맥락에서 R100943은 NNRTI의 배좌 교체를 가능하게 하는 비틀림 자유를 갖는다. 이 비틀림 자유는 ITU 유도체가 돌연변이 NNIB에 결합해 저항 돌연변이의 영향을 보상하는 데 사용할 수 있다. 그럼에도 불구하고, HIV-1 내성 돌연변이에 대한 R100943의 효력은 효과적인 약물 후보로 간주하기에 충분하지 않았다. 게다가 ITU 유도체의 이미도일싸이오우레아 부분의 화학적 안정성은 경구용 약물에 적합하지 않았다.[10][18][19]
각주[편집]
- ↑ 가 나 다 라 마 Ivetac A, McCammon JA (May 2009). “Elucidating the inhibition mechanism of HIV-1 non-nucleoside reverse transcriptase inhibitors through multicopy molecular dynamics simulations”. 《Journal of Molecular Biology》 388 (3): 644–58. doi:10.1016/j.jmb.2009.03.037. PMC 2744402. PMID 19324058.
- ↑ 가 나 De Clercq E (August 2005). “Antiviral drug discovery and development: where chemistry meets with biomedicine”. 《Antiviral Research》 67 (2): 56–75. doi:10.1016/j.antiviral.2005.05.001. PMID 16046240.
- ↑ 가 나 Jochmans D (June 2008). “Novel HIV-1 reverse transcriptase inhibitors”. 《Virus Research》 134 (1–2): 171–85. doi:10.1016/j.virusres.2008.01.003. PMID 18308412.
- ↑ 가 나 다 De Clercq E (April 2009). “Anti-HIV drugs: 25 compounds approved within 25 years after the discovery of HIV”. 《International Journal of Antimicrobial Agents》 33 (4): 307–20. doi:10.1016/j.ijantimicag.2008.10.010. PMID 19108994.
- ↑ Ren J, Bird LE, Chamberlain PP, Stewart-Jones GB, Stuart DI, Stammers DK (October 2002). “Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors”. 《Proceedings of the National Academy of Sciences of the United States of America》 99 (22): 14410–5. Bibcode:2002PNAS...9914410R. doi:10.1073/pnas.222366699. PMC 137897. PMID 12386343.
- ↑ 가 나 다 Sosnik A, Chiappetta DA, Carcaboso AM (August 2009). “Drug delivery systems in HIV pharmacotherapy: what has been done and the challenges standing ahead”. 《Journal of Controlled Release》 138 (1): 2–15. doi:10.1016/j.jconrel.2009.05.007. PMID 19445981.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 de Béthune MP (January 2010). “Non-nucleoside reverse transcriptase inhibitors (NNRTIs), their discovery, development, and use in the treatment of HIV-1 infection: a review of the last 20 years (1989-2009)”. 《Antiviral Research》 85 (1): 75–90. doi:10.1016/j.antiviral.2009.09.008. PMID 19781578.
- ↑ 가 나 다 라 마 Basavapathruni A, Anderson KS (December 2007). “Reverse transcription of the HIV-1 pandemic”. 《FASEB Journal》 21 (14): 3795–808. doi:10.1096/fj.07-8697rev. PMID 17639073.
- ↑ 가 나 Prajapati DG, Ramajayam R, Yadav MR, Giridhar R (August 2009). “The search for potent, small molecule NNRTIs: A review”. 《Bioorganic & Medicinal Chemistry》 17 (16): 5744–62. doi:10.1016/j.bmc.2009.06.060. PMID 19632850.
- ↑ 가 나 다 라 마 바 Das K, Lewi PJ, Hughes SH, Arnold E (June 2005). “Crystallography and the design of anti-AIDS drugs: conformational flexibility and positional adaptability are important in the design of non-nucleoside HIV-1 reverse transcriptase inhibitors”. 《Progress in Biophysics and Molecular Biology》 88 (2): 209–31. doi:10.1016/j.pbiomolbio.2004.07.001. PMID 15572156.
- ↑ Bal TR, Anand B, Yogeeswari P, Sriram D (October 2005). “Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives”. 《Bioorganic & Medicinal Chemistry Letters》 15 (20): 4451–5. doi:10.1016/j.bmcl.2005.07.046. PMID 16115762.
- ↑ Samuele A, Kataropoulou A, Viola M, Zanoli S, La Regina G, Piscitelli F, Silvestri R, Maga G (January 2009). “Non-nucleoside HIV-1 reverse transcriptase inhibitors di-halo-indolyl aryl sulfones achieve tight binding to drug-resistant mutants by targeting the enzyme-substrate complex”. 《Antiviral Research》 81 (1): 47–55. doi:10.1016/j.antiviral.2008.09.008. PMID 18984007.
- ↑ Van Gyseghem E, Pendela M, Baert L, Rosier J, Van 't Klooster G, De Man H, Bouche MP, Schueller L, Van Remoortere P, Wigerinck P, Adams E, Hoogmartens J, Van den Mooter G (November 2008). “Powder for reconstitution of the anti-HIV-1 drug TMC278 - Formulation development, stability and animal studies”. 《European Journal of Pharmaceutics and Biopharmaceutics》 70 (3): 853–60. doi:10.1016/j.ejpb.2008.06.030. PMID 18657611.
- ↑ D'Cruz OJ, Uckun FM (March 2006). “Dawn of non-nucleoside inhibitor-based anti-HIV microbicides”. 《The Journal of Antimicrobial Chemotherapy》 57 (3): 411–23. doi:10.1093/jac/dki464. PMID 16431862.
- ↑ 가 나 Sluis-Cremer N, Tachedjian G (June 2008). “Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors”. 《Virus Research》 134 (1–2): 147–56. doi:10.1016/j.virusres.2008.01.002. PMC 2745993. PMID 18372072.
- ↑ Schauer GD, Huber KD, Leuba SH, Sluis-Cremer N (October 2014). “Mechanism of allosteric inhibition of HIV-1 reverse transcriptase revealed by single-molecule and ensemble fluorescence”. 《Nucleic Acids Research》 42 (18): 11687–96. doi:10.1093/nar/gku819. PMC 4191400. PMID 25232099.
- ↑ Ludovici DW, Kukla MJ, Grous PG, Krishnan S, Andries K, de Béthune MP, Azijn H, Pauwels R, De Clercq E, Arnold E, Janssen PA (September 2001). “Evolution of anti-HIV drug candidates. Part 1: From alpha-anilinophenylacetamide (alpha-APA) to imidoyl thiourea (ITU)”. 《Bioorganic & Medicinal Chemistry Letters》 11 (17): 2225–8. doi:10.1016/S0960-894X(01)00410-3. PMID 11527703.
- ↑ Hsiou Y, Das K, Ding J, Clark AD, Kleim JP, Rösner M, Winkler I, Riess G, Hughes SH, Arnold E (November 1998). “Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance”. 《Journal of Molecular Biology》 284 (2): 313–23. doi:10.1006/jmbi.1998.2171. PMID 9813120.
- ↑ Das K, Ding J, Hsiou Y, Clark AD, Moereels H, Koymans L, Andries K, Pauwels R, Janssen PA, Boyer PL, Clark P, Smith RH, Kroeger Smith MB, Michejda CJ, Hughes SH, Arnold E (December 1996). “Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant”. 《Journal of Molecular Biology》 264 (5): 1085–100. doi:10.1006/jmbi.1996.0698. PMID 9000632.
