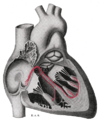
굴심방결절
| 굴심방결절 | |
|---|---|
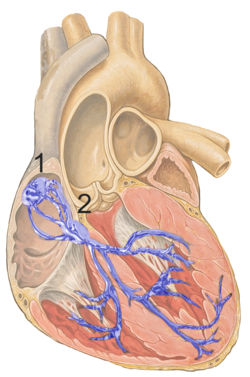 심장의 전기 전도계를 파란색으로 표시한 그림. 굴심방결절은 1로 표시되었다. | |
| 정보 | |
| 기관계 | 심장 전기 전도계 |
| 동맥 | 굴심방결절동맥 |
| 식별자 | |
| 라틴어 | nodus sinuatrialis |
| 영어 | sinoatrial node |
| MeSH | D012849 |
| TA98 | A12.1.06.003 |
| TA2 | 3953 |
| FMA | 9477 |
굴심방결절(窟心房結節, 영어: Sinoatrial node), 또는 동방결절(洞房結節, 영어: Sinuatrial node, SA node, sinus node)은 심장의 우심방 벽에 위치한, 심박조율기(pacemaker) 세포로 알려진 세포의 그룹이다.[1] 이 세포는 심장 전도계를 통해 이동하는 전기 충격(활동전위)을 생성하여 심장을 수축시킨다. 건강한 심장에서 굴심방결절은 지속적으로 활동 전위를 생성하여 심장의 리듬(굴리듬)을 설정하므로 자연적인 심박조율기로 알려져 있다. 생성된 활동 전위의 비율(심박수)은 활동전위를 만드는 신경의 영향을 받는다.[2]
구조[편집]
동방결절은 크기가 다양한 바나나 모양의 구조물로 일반적으로 길이는 10~30mm, 너비가 5~7mm, 깊이는 1–2mm 정도이다.[3][4]
위치[편집]
굴심방결절은 우심방의 벽(심장바깥막)에 위치하며, 대정맥굴이라고 하는 위대정맥 입구의 가쪽에 위치한다.[5] 대략 심장의 안쪽 표면에 위치한 분계능선과 바깥쪽 표면에서 대응하는 분계고랑 사이에 위치한다.[2] 분계고랑은 위대정맥 입구와 아래대정맥 사이에 있다.
미세해부학[편집]
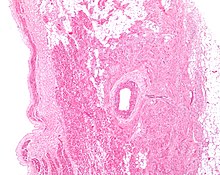
굴심방결절의 세포는 신경, 혈관, 콜라겐, 지방을 포함하는 결합 조직의 그물망 구조 내에 퍼져 있다. 굴심방결절 세포를 직접 둘러싸고 있는 것은 결절주변세포(paranodal cells)이다.[2] 결합 조직은 결절주변세포와 함께 굴심방결절 세포를 나머지 심방과 절연시켜 심방 세포의 전기적 활동이 굴심방결절 세포에 영향을 미치는 것을 방지한다.[2] 굴심방결절 세포는 주변 심방 세포보다 작고 옅다. 굴심방결절 세포의 평균 직경은 약 8μm이고 길이는 20-30μm 정도이다.(1μm = 0.000001m)[6] 심방 세포와 달리 굴심방결절 세포에는 더 적은 수의 미토콘드리아와 근섬유가 있고, 근소포체가 더 작다. 이것은 굴심방결절 세포가 심방이나 심실의 세포에 비해 수축하는 데에는 덜 준비되어 있다는 것을 의미한다.[7]
활동전위는 간극연접으로 알려진 구멍을 통해 한 심장 세포에서 다음 심장 세포로 전달된다. 이러한 간극연접은 커넥신이라고 하는 단백질로 구성된다. 굴심방결절 내의 간극연접은 수도 적고 크기도 더 작다. 이것도 주변 심방 세포와 굴심방결절 사이 전류를 끊는(절연하는) 데에 중요하다.[2]
혈액 공급[편집]
굴심방결절은 굴심방결절동맥으로부터 혈액 공급을 받는다. 그러나 이 혈액 공급은 개인마다 크게 다를 수 있다. 예를 들어, 대부분의 사람에서 굴심방결절동맥은 하나의 동맥이지만 어떤 경우에는 두세 개의 굴심방결절동맥이 혈액을 공급한다. 또한 굴심방결절동맥은 주로 오른관상동맥의 가지에서 시작되지만, 일부에서는 왼관상동맥의 휘돌이가지에서 시작된다. 마지막으로, 굴심방결절동맥은 일반적으로 굴심방결절에 도달하기 전에 위대정맥 뒤쪽을 통과한다. 그러나 어떤 경우에는 앞쪽으로 통과한다. 이렇게 많은 차이점이 있지만, 사람마다 가지고 있는 굴심방결절동맥의 수나 시작 위치에 따라 이점이 있지는 않은 것으로 보인다.[8]
정맥 배출[편집]
굴심방결절에서 혈액을 빼내는 큰 정맥은 없다. 대신, 더 작은 세정맥이 혈액을 우심방으로 직접 배출한다.[9]
기능[편집]
심박 조율[편집]
굴심방결절 세포의 주요 역할은 심근 세포를 통과하여 수축을 일으키는 심장의 활동전위를 발생시키는 것이다. 활동전위는 전하를 띤 원자(이온)의 이동에 의해 생성되는 막 전위의 급격한 변화이다. 자극이 없을 때 심박조율 세포가 아닌 세포(심실, 심방의 세포 등)는 비교적 일정한 막 전위를 가진다. 이 시기의 막 전위를 휴지 전위라고 한다. 이 휴지기는 활동전위가 해당 세포에 도달하면 종료된다. 활동전위는 심장 전체에 전달되고 근수축을 시작하는 탈분극이 일어나, 막 전위가 (+) 방향으로 변화한다. 그러나 심박조율 세포에는 휴지 전위가 존재하지 않는다. 대신, 재분극 직후 심박조율 세포의 막 전위는 자동으로 다시 느리게 탈분극되기 시작하며, 이때의 막 전위를 박동조율기 전위라고 한다. 박동조율기 전위가 설정된 값인 문턱값 전위에 도달하면 활동전위가 생성된다.[2] 푸르키네 섬유[10]나 방실결절의 세포와 같은 심장 내의 다른 세포도 활동전위를 생성할 수 있다. 그러나 굴심방결절 세포 이외의 세포는 활동전위 생성이 더 느리므로 굴심방결절이 제대로 기능하고 있으면 일반적으로 굴심방결절이 생성한 활동 전위가 다른 조직에서 생성한 활동전위보다 우선한다.[11]
아래에는 굴심방결절 활동전위의 3단계가 요약되어 있다. 심장 활동전위에는 0~4단계까지 총 5단계가 있지만 심박조율 세포의 활동 전위에는 명백한 1단계나 2단계가 나타나지 않는다.
4단계

4단계는 박동조율기 전위라고도 한다. 재분극 직후 막 전위가 매우 음의 값을 가질 때(과분극 상태) 전압이 천천히 증가하기 시작한다. 전압이 증가하는 것은 초기에 칼륨 통로가 닫혀서 이는 세포 밖으로 흐르는 칼륨 이온 전류(I k)가 감소하기 때문이다(아래 2단계 참조).[12] 또한 과분극은 HCN 통로를 활성화시킨다. 음의 막 전위에서 이온 통로가 활성화되는 것은 일반적이지 않으므로, 활성화된 HCN 채널을 통한 나트륨 이온과 일부 칼륨 이온의 흐름을 박동조율기 전류, 또는 재밌는 전류(funny current, I f )라고 한다.[13] 박동조율기 전류를 통해 양전하(Na+, K+)가 세포로 흐르면서 세포의 막 전위를 점진적으로 증가시킨다. 박동조율기 전위와 관련된 또 다른 기전은 칼슘 저장고인 근소포체에서 세포질로 칼슘이 자발적으로 방출되는 과정이다. 세포 내 칼슘 농도가 이런 식으로 증가하면 나트륨-칼슘 교환체(NCX)를 활성화하여 세포에서 하나의 Ca2+를 내보내고 3Na+를 세포 안으로 들여보내 서로 교환한다. 따라서 세포에서 +2의 전하를 제거하며 +3의 전하가 세포에 들어가도록 하여 막 전위를 더욱 증가시킨다. 칼슘은 나중에 SERCA와 세포막에 위치한 칼슘 통로를 통해 세포로 다시 들어간다.[14] 이러한 기전에 의해 막 전위가 증가하면서 T형 칼슘 통로를 활성화한 다음 L형 칼슘 통로(T형보다 매우 느리게 열림)를 활성화시킨다. 칼슘 통로는 세포 안으로 Ca2+이 들어오게 하여 막 전위를 훨씬 더 큰 양의 값으로 만든다.
0단계
0단계는 탈분극 단계이다. 막 전위가 문턱값 전위(약 -20 ~ -50mV)에 도달하면 세포가 빠르게 탈분극되기 시작하면서 막 전위는 더 양의 값이 된다.[15] 탈분극은 주로 완전히 열린 L형 칼슘 통로를 통해 Ca2+이 들어오기 때문에 발생한다. 이 단계에서 T형 칼슘 통로와 HCN 통로는 비활성화된다.
3단계
3단계는 재분극 단계이다. 이 단계에서는 L형 칼슘 통로가 비활성화되면서 Ca2+가 세포로 들어가는 것이 막히고, 칼륨 통로가 활성화되면서 발생한다. 칼륨 통로가 활성화되면 세포 밖으로 K+가 나가면서 막 전위를 음의 방향으로 이동시킨다.[16]
신경 분포[편집]
심박수는 굴심방결절이 활동전위를 생성하는 속도에 따라 달라진다. 휴식 시 정상 심박수는 분당 60~100회이다. 심박수는 두 가지 신경 계통의 활동으로 인해 결정된다. 하나는 활동 전위 생성을 늦추는 작용을 하는 부교감신경이며, 다른 하나는 활동전위 생성을 빠르게 하는 교감신경이다.[17]
교감신경은 척수신경의 등뼈 부위(특히 T1-T4)에서 시작된다. 이 신경은 노르에피네프린이라는 신경전달물질을 방출한다. 노르에피네프린은 베타-1 아드레날린 수용체라고 하는 굴심방결절 막의 수용체에 결합한다. 이 수용체에 노르에피네프린이 결합하면 고리형 아데노신 일인산(cAMP)라고 하는 분자를 생산하는 일련의 반응(cAMP 의존적 경로)을 개시하는 G단백질(특히 반응을 자극하는 경우 Gs)을 활성화한다. 이 cAMP는 HCN 통로에 결합한다. cAMP가 HCN 통로에 결합하면 위의 4단계 문단에서 나온 대로, 세포 안으로 Na+와 K+이 유입되어 박동조율기 전위가 빨라지고, 활동전위가 생성 속도도 빨라져 심박수가 증가한다.[18] 심박수의 증가는 양성 심박수변동(chronotropy) 효과라고 한다.
특히 미주신경을 중심으로 한, 굴심방결절에 분포하는 부교감신경은 뇌에서 시작된다. 이 신경은 아세틸콜린(ACh)이라는 신경전달물질을 방출한다. ACh는 굴심방결절 막에 위치한 무스카린성 아세틸콜린 수용체 M2라는 수용체에 결합한다. M2 수용체가 활성화되면 G단백질(특히 억제성인 Gi)을 활성화시킨다. 이 G단백질이 활성화되면 cAMP 경로를 차단하여 교감신경 활동을 억제시키고 활동전위 생성을 늦춘다. 또한 G단백질은 칼륨 통로를 활성화시켜 K+가 세포 밖으로 흘러나가도록 하여 막 전위를 더 음의 방향으로 만들고, 박동조율기 전위를 느리게 하여 활동전위 생성 속도를 감소시키고 결국 심박수를 감소시킨다.[19] 심박수의 감소를 음성 심박수변동 효과라고 한다.
굴심방결절에서 활동전위를 생성하는 첫 번째 세포가 항상 동일한 것은 아니다. 활동전위를 처음 만드는 세포가 달라지는 현상을 심박조율기 이동(pacemaker shift)이라고 한다. 개와 같은 특정 동물 종에서, 굴심방결절에서 가장 빠른 활동전위를 생성하는 세포가 이전보다 높아지면 일반적으로 심박수를 증가시키는 반면 반대로 첫 번째 활동전위를 만드는 세포가 내려가면 심박수가 감소한다.[2]
임상적 중요성[편집]
굴심방결절 기능 장애는 심장의 잘못된 전기 신호로 인해 심장 박동이 불규칙해지는 것이다. 심장의 굴심방결절에 결함이 있는 경우 심장의 리듬이 비정상적으로 변한다. 일반적으로 너무 느리거나 기능, 조합이 일시 중지되는 식으로 나타나고, 정상보다 박동이 빠른 경우는 매우 드물다.[20]
따라서 굴심방결절로 가는 동맥혈 공급이 차단(가장 일반적으로 심근 경색이나 진행성 관상동맥질환으로 인해 발생)되면 굴심방결절에서 허혈과 세포 사멸을 유발할 수 있다. 이로 인해 굴심방결절의 전기적 박동조율기 기능이 방해될 수 있으며, 굴기능 부전 증후군의 원인이 될 수 있다.
굴심방결절이 제대로 기능하지 못하거나 굴심방결절에서 생성된 전기 신호가 전기 전도계를 따라 이동하기 전에 차단(굴심방차단)되면 아래쪽에 있는 세포들이 대신 박동조율기 역할을 한다.[21]
역사[편집]
굴심방결절은 당시 젊은 의대생이었던 마틴 플랙(Martin Flack)이 멘토였던 아서 키스(Arthur Keith) 경과 함께 두더지의 심장에서 처음 발견했다. 그들은 Mann's Place라는 영국 켄트주의 한 농가에 임시 실험실을 마련했다. 이 발견은 1907년에 출판되었다.[22][23]
추가 이미지[편집]
-
심장의 전도계. 굴심방결절은 1로 표시됨.
-
방실 다발의 모식도.
같이 보기[편집]
참고 문헌[편집]
- ↑ Keith, A; Flack, M (1907). “The Form and Nature of the Muscular Connections between the Primary Divisions of the Vertebrate Heart”. 《J Anat Physiol》 41 (3): 172–189. PMC 1289112. PMID 17232727.
- ↑ 가 나 다 라 마 바 사 Monfredi, O.; Dobrzynski, H.; Mondal, T.; Boyett, M.R.; Morris, G.M. (2010). “The anatomy and physiology of the Sinoatrial Node-A contemporary review”. 《Pacing and Clinical Electrophysiology》 33 (11): 1392–1406. doi:10.1111/j.1540-8159.2010.02838.x. PMID 20946278.
- ↑ Csepe, Thomas A.; Zhao, Jichao; Hansen, Brian J.; Li, Ning; Sul, Lidiya V.; Lim, Praise; Wang, Yufeng; Simonetti, Orlando P.; Kilic, Ahmet (2017년 3월 1일). “Human Sinoatrial Node Structure: 3D Microanatomy of Sinoatrial Conduction Pathways”. 《Progress in Biophysics and Molecular Biology》 120 (1–3): 164–178. doi:10.1016/j.pbiomolbio.2015.12.011. ISSN 0079-6107. PMC 4808362. PMID 26743207.
- ↑ Chandler, N.; Aslanidi, O.; Buckley, D.; Inada, S.; Birchall, S.; Atkinson, A.; Kirk, D.; Monfredi, O.; Molenaar, P. (2011). “Computer three-dimensional anatomical recon-struction of the human sinus node and a novel paranodal area”. 《Anatomical Record》 294 (6): 970–9. doi:10.1002/ar.21379. PMID 21538926.
- ↑ 《Dorland's Illustrated Medical Dictionary》, Elsevier, 2014년 1월 11일에 원본 문서에서 보존된 문서, 2022년 4월 21일에 확인함Elsevier
- ↑ Honjo, H.; Boyett, M.R.; Kodama, I.; Toyama, J. (1996). “Correlation between electrical activity and the size of rabbit sino-atrial node cells”. 《The Journal of Physiology》 496 (3): 795–808. doi:10.1113/jphysiol.1996.sp021728. PMC 1160865. PMID 8930845.
- ↑ Boyett, Honjo; Kodama, I. (2000). “The sinoatrial node, a heterogeneous pace-maker structure”. 《Cardiovascular Research》 47 (4): 658–87. doi:10.1016/s0008-6363(00)00135-8. PMID 10974216.
- ↑ Vikse, J.; Henry, B.M.; Roy, J.; Ramakrishnan, P.K.; Hsieh, W.C.; Walocha, J.A.; Tomaszewski, K.A. (2016b). “Anatomical variations in the Sinoatrial Nodal artery: A Meta-Analysis and clinical considerations”. 《PLOS ONE》 11 (2): e0148331. Bibcode:2016PLoSO..1148331V. doi:10.1371/journal.pone.0148331. PMC 4743947. PMID 26849441.
- ↑ Anderson, K.R.; Ho, S.Y.; Anderson, R.H. (1979). “Location and vascular supply of sinus node in human heart”. 《Heart》 41 (1): 28–32. doi:10.1136/hrt.41.1.28. PMC 514694. PMID 426954.
- ↑ Tsien, R. W.; Carpenter, D. O. (1978년 6월 1일). “Ionic mechanisms of pacemaker activity in cardiac Purkinje fibers”. 《Federation Proceedings》 37 (8): 2127–2131. ISSN 0014-9446. PMID 350631.
- ↑ Vassalle, M. (1977). “The relationship among cardiac pacemakers: Overdrive suppression”. 《Circulation Research》 41 (3): 269–77. doi:10.1161/01.res.41.3.269. PMID 330018.
- ↑ Irisawa, H; Brown, HF; Giles, W (1993). “Cardiac pacemaking in the sinoatrial node”. 《Physiol Rev》 73 (1): 197–227. doi:10.1152/physrev.1993.73.1.197. PMID 8380502.
- ↑ DiFrancesco, D (2010). “The role of the funny current in pacemaker activity”. 《Circulation Research》 106 (3): 434–46. doi:10.1161/circresaha.109.208041. PMID 20167941.
- ↑ Joung, B.; Chen, P.; Lin, S. (2011). “The role of the calcium and the voltage clocks in sinoatrial node dysfunction”. 《Yonsei Medical Journal》 52 (2): 211–9. doi:10.3349/ymj.2011.52.2.211. PMC 3051220. PMID 21319337.
- ↑ Verkerk, A., Borren, van, Peters, R., Broekhuis, E., Lam, K., Coronel, R., Bakker, de, Tan, H. and Wilders, R. (2007) 'Single cells isolated from human sinoatrial node: Action potentials and numerical reconstruction of pacemaker current’, Conference proceedings : ... Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual Conference., 2007, pp. 904–7.
- ↑ Clark, R.B.; Mangoni, M.E.; Lueger, A.; Couette, B.; Nargeot, J.; Giles, W.R. (2004). “A rapidly activating delayed rectifier K+ current reg-ulates pacemaker activity in adult mouse sinoatrial node cells”. 《American Journal of Physiology. Heart and Circulatory Physiology》 286 (5): 1757–1766. doi:10.1152/ajpheart.00753.2003. PMID 14693686.
- ↑ Gordan, R.; Gwathmey, J.K.; Xie, L.-H. (2015). “Autonomic and endocrine control of cardiovascular function”. 《World Journal of Cardiology》 7 (4): 204–14. doi:10.4330/wjc.v7.i4.204. PMC 4404375. PMID 25914789.
- ↑ Larsson, P.H. (2010) 'How is the heart rate regulated in the sinoatrial node? Another piece to the puzzle’, 136(3).
- ↑ Osterrieder W., Noma A., Trautwein W. (1980) On the kinetics of the potassium current activated by acetylcholine in the SA node of the rabbit heart. Pflügers Arch. 386:101–109.
- ↑ Sinus node dysfunction Mount Sinai Hospital, New York
- ↑ Junctional Rhythm - eMedicine
- ↑ Silverman, M.E.; Hollman, A. (2007년 10월 1일). “Discovery of the sinus node by Keith and Flack: on the centennial of their 1907 publication”. 《Heart》 93 (10): 1184–1187. doi:10.1136/hrt.2006.105049. PMC 2000948. PMID 17890694.
- ↑ Boyett MR, Dobrzynski H (June 2007). “The sinoatrial node is still setting the pace 100 years after its discovery”. 《Circ. Res.》 100 (11): 1543–5. doi:10.1161/CIRCRESAHA.107.101101. PMID 17556667.
외부 링크[편집]
- gru.net의 다이어그램
- thoraxlesson4 Wesley Norman의 The Anatomy lesson (조지타운 대학교) (thoraxheartinternalner)
- https://web.archive.org/web/20070929080346/http://www.healthyheart.nhs.uk/heart_works/heart03.shtml