녹색 형광 단백질

녹색 형광 단백질(Green Fluorescent Protein, GFP)은 1962년 일본의 해양생물학자인 시모무라 오사무가 해파리 Aequorea victoria의 형광 물질을 연구하는 도중 처음 발견되었으며, 1969년 Hasting 과 Morin에 의해 녹색 형광 단백질로 명명되었다. GFP는 생체 내에서 칼슘에 의해 활성된 발광단백질(Photoprotein)이나 루시페레이스-옥시루시페린 복합체의 에너지를 운반하는 에너지 전달 수용체로 작용하며, 에쿼린(Aequorin)으로부터 에너지를 받아 508nm의 녹색 형광을 방출하는 2차 형광 단백질로서 작용한다. 세포에 이 GFP를 암호화하고 있는 DNA나 mRNA가 존재할 경우, 이내 GFP 단백질이 세포 내에서 합성되어 강한 형광을 발한다. 발현 정도를 조사하고 싶은 유전자에 GFP를 암호화하는 서열을 연결하면 실제 조사하길 원하는 유전자가 발현하는 장소에서 GFP가 형광을 발현하게 되므로, 유전자의 발현을 조사하는데 많이 사용한다. 특히 관찰이 용이하고 독성을 지니고 있지 않다는 장점으로 인해, 유전자의 발현의 유무와 장소, 시간 측정 등 다양한 분야에서 사용되고 있다. 이와 기능적으로 유사한 노랑 형광 단백질(YFP), 청록색 형광 단백질(CFP)도 개발되었으며 이 외에도 적색, 청색등 다양한 색의 형광 단백질이 만들어져있다. 이렇게 다양한 형광 단백질은 여러 단백질의 지역분포를 한번에 알아보고자 할 때 유용하게 사용된다. 2008년 시모무라 오사무, 마틴 챌피, 로저 첸이 녹색 형광 단백질의 연구를 통해 노벨화학상을 수상했다.[1]
구조
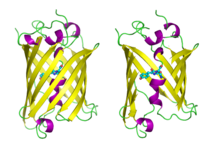
입체 구조
- 238개의 아미노산이 26.9kDa의 녹색 형광 단백질(Green Fluorescent Protein)을 이루고 있다.
- 녹색 형광 단백질의 둘레에는 11개의 베타 병풍(beta sheet) 구조가 베타 베럴(Beta berrel)을 이룬다.
- 녹색 형광 단백질의 위, 아래에는 각각 루프 구조(loop structure)가 존재한다.
- 베타베럴 내부에는 세린65-타이로신66-글라이신67이 존재한다. 이 세 가지 아미노산이 형광체(fluorophore)를 이루며, 이로 인해 녹색 형광이 만들어진다.
형광체
녹색 형광 단백질의 녹색 형광은 Ser65-Tyr66-Gly67에서 발광된다. Ser65-Tyr66-Gly67은 번역 후 변형 과정에서 1)접힘(folding) 2)고리화(cyclization) 3)탈수화(dehydrogenation) 4)산화(oxydation)의 과정을 통해 특징적인 형광체 구조로 변형된다.
생물학적 마커로서의 장점
녹색 형광 단백질은 기본적으로 생물 연구에 있어서 원하는 것을 보기 위한 표지자로서 사용된다. 녹색 형광 단백질이외에도 표지자 기능을 할 수 있는 도구들을 여러 가지가 있지만 특별히 녹색 형광 단백질만이 가지는 특징이 있어서 녹색 형광 단백질이 매우 인기있는 수단으로 이용된다. 그 특징은 다음과 같다.
- 녹색 형광 단백질은 짧은 길이의 단백질 조각으로서 단위체만으로도 그 기능을 할 수 있다. 즉, 해파리에서 녹색 형광 단백질 유전자 이외에 형광을 내기 위해 필요한 추가적인 요소가 없다. 대부분의 경우 한 동물에서 특수한 기능을 담당하는 단백질은 본체 뿐만 아니라 그 기구를 잘 작동하게 해 주기 위한 다른 효소들이 필요하다. 하지만 녹색 형광 단백질은 빛을 받아서 형광을 내는 단백질이므로 형광체(fluorophore)만 있으면 기능이 가능하며, 그 외에 반응을 위한 이온 등의 보조인자도 필요하지 않다. 따라서 손쉽게 다른 유전자 속에 주입해 형광 발현을 확인할 수 있다.
- 녹색 형광 단백질은 살아있는 세포가 스스로 유전자를 발현하고 단백질을 생성해서 만들어 지는 것이므로 세포에게 독성이 없다. 따라서 이전의 많은 염색 방법들과 다르게 세포가 살아있는 상태에서 원하는 것을 관찰할 수 있다는 뛰어난 장점이 있다.
이용 분야

GFP는 사실 거의 모든 연구에 사용될 수 있는 도구 이므로 GFP가 어디에 사용 되나요? 라는 질문을 한다면 생물학의 모든 분야를 하나씩 나열하는 것이 그 대답이 될 수 있을 정도로 방대하게 이용될 수 있다. 따라서 이것을 좀 더 체계적으로 이해하기 위하여 연구의 목적에 따라 4가지로 이용 방법을 분류해 보았다.
단백질의 위치 확인
위치를 확인하고자 하는 단백질 유전자를 녹색 형광 단백질과 연결해서 유전자를 조작해 주면 개체 내에서 특정 단백질이 어떤 모양으로 어디에 위치하는지를 알 수 있다. 예를 들어서 액틴 프로모터 뒤에 녹색 형광 단백질을 넣어준 꼬마선충(C.elegans)을 보면 액틴의 가는 섬유가 녹색 형광으로 빛이 나는 모습을 형광 현미경 아래에서 관찰 할 수 있다.
세포 내 물질의 메커니즘 및 운동성 확인
녹색 형광 단백질의 절대적인 장점은 살아있는 세포의 모습을 관찰 할 수 있다는 것이다. 이전의 방법에서는 특정 시점에서 정지한 모습만 관찰할 수 있었던 것에 반해, 녹색 형광 단백질은 단백질이 이동하는 모습이나, 자극에 대한 반응 등 세포가 살아있어야만 알 수 있는 많은 것들을 보여준다. 예를 들어 시냅스에서의 반응연구, 인간면역결핍바이러스-human immunodificiency vius-HIV의 감염 경로, 암세포의 전이, 발생과정에서 특정 단백질의 역할 등의 많은 것을 알 수 있다.
동물에서 유전자 발현 확인
녹색 형광 단백질에 관련된 기사를 검색해보면 여러 가지 실험동물에서의 녹색 형광 단백질 발현이 성공했다는 이야기를 볼 수 있다. 그런데 왜 여러 동물에서 녹색 형광 단백질이 발현되는 것을 확인하고 싶은 것일까? 왜냐하면 우리가 동물개체를 통해 생산하고자 하는 많은 유용한 유전자들의 발현이 가능할 지도 모른다는 의미를 가지기 때문이다. 체세포 복제를 통해 인슐린 유전자를 발현하는 닭을 만들 때 우리가 주입한 인슐린 유전자가 올바르게 들어갔는지 아닌지를 확인하는 것은 쉬운 일이 아니다. 이 때 원하는 자리에 녹색 형광 단백질을 넣어보면 태어난 개체에서 형광이 나오는지 여부를 보고 성공이냐 실패냐를 알 수 있을 것이다. 가장 최근의 성과로서 충북대 동물바이오신약 장기개발사업단 에서 형질전환형광한우송아지를 탄생시켰다. 이전의 연구에서 생쥐, 닭, 물고기 등에서 녹색 형광 단백질을 발현한 적은 있지만 소와같이 큰 동물에서 발현한 사례는 처음이다. 소와 같이 큰 동물에서 유전자 생산을 할 수 있을 가능성이 열림에 따라서, 고가의 치료의 단백질을 현재 생산하는 품질보다 더 우수한것으로 만들 수 있게 될 것이다.
형광 그 자체를 얻고자 하는 경우
마지막 경우는 상당히 예외적인 경우로서, 형광 그 자체를 얻기 위한 방법이다. 예를 들면 대한민국 농촌진흥청에서 만들어낸 형광색 실을 뽑는 누에고치가 있다.
그 외의 형광 물질

다음의 형광 단백질은 녹색 형광 단백질의 아미노산 중 일부분의 돌연변이(mutation)에 의해 만들어진다. 파랑 형광 단백질(BFP; Blue fluorescent protein)는 375nm를 흡수하고 435nm의 파장을 방출한다. 청록색 형광 단백질(CFP; Cyan fluorescent protein)는 425nm을 흡수하고 480nm을 방출한다. 녹색 형광 단백질(GFP; Green fluorescent protein)는 480nm를 흡수하고 노랑 형광 단백질(YFP; Yellow fluorescent protein) 540nm를 흡수하고 550nm를 방출한다.
청록색 형광 단백질
청록색 형광 단백질(CFP; Cyan Fluorescent Protein)은 2008년 노벨화학상 수상자인 로저 첸(Roger Yonchien Tsien)에 의해 만들어졌다. 청록색 형광 단백질은 녹색형광단백질(GFP; Green Fluorescent Protein)를 돌연변이 시킴으로써 만들어진다. 녹색형광단백질(GFP)은 아미노산 238개로 이루어져있다. 그 중 65번째 아미노산인 세린(serine)이 트레오닌(threonine)으로 바뀌면 청록색형광단백질(CFP)이 만들어진다. 청록색 형광단백질은 파랑색 파장 영역대 의 빛을 흡수하고 청록색 파장 영역의 빛을 내보낸다.
참고자료
같이 보기
각주
참고 문헌
- Introduction to fluorescent proteins
- Nature journal article describing eGFP protein
- Roger Y. Tsien(1998) 'The Green Fluorescent Protein'
- Haruki Niwa(1996) "Chemical nature of the light emitter of the Aequorea green fluorescent protein"
- Mathias Stotz, Biomolecular Structure(2005) "Green Fluorescent Protein (GFP) and it’s relatives"
- Zhang J(2002) "Creating new fluorescent probes for cell biology"
- Roger Y. Tsien(2009) "yellow fluorescent protein"
