스캐폴드 단백질
생물학에서 스캐폴드 단백질은 신호 전달에서 매우 중요한 조절자로서의 역할을 지닌다. 스캐폴드 단백질의 정확한 기능과 성질은 밝혀져 있지 않지만 기초물질의 단백질로서, 그들은 신호 전달 물질들을 단백질 복합체로 합성하면서 신호 전달 과정에서 많은 상호 작용을 하는 것으로 알려져있다. 이러한 신호 전달 과정에서 스캐폴드 단백질은 신호 형질 도입을 조절하고, 원형질막, 세포질, 세포 핵, 골지체, 엔도솜, 그리고 미토콘드리아와 같은 세포 내 특정 위치로 (복합체로 구성된) 신호 전달 물질들을 전달하는 과정에 큰 역할을 한다.
역사[편집]
가장 먼저 발견된 신호 전달 스캐폴드 단백질은사카로미세스 세레비시아 효모에서 추출한 Ste5 단백질이다. Ste5 단백질의 세 개의 특정 부위에 키네이스 단백질인 Ste11, Ste7, Fus3이 붙어 복합키네이스 화합물을 형성하면서 상호 작용하는 것으로 밝혀졌다.[2]
종류[편집]
핵스캐폴드단백질은 핵막공복합체와 핵라미나를 구성하는 것을 제외하면 내부 기질에서 유래한 많은 종류가 있다. 그 예로는 DNA 도포중합효소Ⅱ등의 효소, RNA결합단백질(hnRNA), 전사인자, 암유전자-암억제유전자산물, 세포주기관련단백질, 스캐폴드부착영역(SAR)결합단백질, 세포골격계의 단백질 등의 여러 갈래로 나뉘며 지속적으로 연구하고 있는 상황이다.
기능[편집]
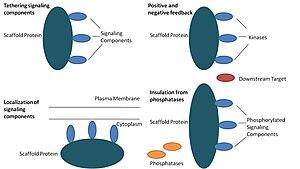
스캐폴드 단백질은 다음 네 개의 역할을 단계적으로 수행한다.
특성[편집]
스캐폴드의 필수조건인 물리화학적 특성은 다음과 같다.
- 세포를 부착하고 전달할 수 있을 것
- 조직성장을 유도분화하고 촉진시킬 것
- 세포 부착될 기질을 타겟화 할 것
- 세포 반응을 자극할 것
- 상처치유가 신속하고 효과적일 것
- 생체적합성이며 생분해성일 것
- 용이한 제조과정과 원하는 형태로 자유자재로 만들어야 할 것
- 큰 표면적의 부피와 큰 다공성을 가질 것
- 기계적 강도와 치수 안정성을 가질 것
- 멸균가능성을 가질 것
신호 전달 물질 복합체 형성[편집]
이 기능은 스캐폴드 단백질의 가장 기본적인 기능으로 알려져있다. 스캐폴드 단백질은 신호전달기작에서의 요소들은 복합체로 만들어 한 곳에 묶어준다. 이러한 복합체 형성은 신호 전달 물질끼리의 불필요한 상호 반응을 최소한으로 줄이고 다른 한 편으로는 신호 전달 과정에서 필요한 요소들을 스캐폴드 복합체에서 모아 줌으로써 신호 전달 과정에서의 효율성을 향상시킬 수 있다. 스캐폴드 단백질이 신호 전달과정에서의 효율성을 높이는 대표적인 예는 스캐폴드 단백질이 인산화효소와 그 기질을 한데 묶음으로서, 특정한 인산화 과정이 원활하게 일어날 수 있도록 보장하는 것이다. 또한, 몇몇 신호 전달 물질은 활성화되기 위해서 여러 가지 가공 과정을 필요로 하는데, 스캐폴드 단백질은 한 번의 상호 작용으로 여러 가지 가공이 일어날 수 있도록 과정을 단순화시킨다.[3][4] 스캐폴드 단백질은 신호 전달 물질과 상호 작용함으로써 알로스테릭 효과를 일으켜 신호 전달을 조절하는 효소적인 성격을 띄고 있기도 하다.[5] 때문에 스캐폴드 단백질은 신호 전달 물질의 활성을 촉진하거나 억제한다. 대표적인 예가 (MAPK) 과정의 미토겐 활성화 키네이스 단백질에 있는 Ste5 스캐폴드 단백질이다. Ste5 단백질은 MAPKK Ste7에 의한 활성화를 위한 특정한 키네이스 단백질의 작용을 촉매적으로 촉진함으로써 Fus3 MAPK을 통한 mating signaling을 직접적으로 관여하는 것으로 알려졌다.[6]
신호 전달 물질의 세포 내부로의 전달[편집]
스캐폴드 단백질이 세포 내부의 특정 부위에 신호 전달 물질을 전달해 주는 작용은 신호 전달 중간 산물 생산에서 매우 중요한 과정이다. 이러한 과정의 가장 대표적인 예는 스캐폴드 단백질의 일종인 키네이스 A 단백질인데, 이 단백질은 cyclic AMP-dependent 단백질을 세포 내 다양한 장소로 보내주는 역할을 한다.[7]
음성 피드백과 양성 피드백과의 상호 작용[편집]
어떻게 스캐폴드 단백질이 음성 피드백, 양성 피드백과 상호작용을 하는지에 대한 많은 가설은 조작된 스캐폴드 단백질과 수학적 모델링 과정을 거쳐서 나오게 된다. 신호 전달 물질인 세 개의 키네이스에 대하여 스캐폴드 단백질은 이 세 개의 키네이스 효소를 모두 묶는다. 이 과정에서 스캐폴드 단백질은 키네이스 효소가 오직 한 가지의 후속 타겟과의 인산화 반응만이 이루어지도록 제한하고, 이 특성이 신호 전달 반응의 무분별한 확장을 제한하고 키네이스 특이성을 향상시킨다.[3][8][9] 이러한 능력은 스캐폴드 단백질과 키네이스와의 상호 작용, 세포 내에서의 기저 인산염 작용, 스캐폴드 단백질 위치, 신호 전달 물질의 발현 정도에서의 안정성과 관련되어 있다고 보여진다.[3][8]
적절한 신호 전달 단백질을 비활성화로부터 보호작용[편집]
신호 전달 과정은 종종 비활성화과정을 일으키거나 신호 전달 물질의 분해를 유도하는 효소들에 의해 비활성화된다. 스캐폴드 단백질은 활성화된 신호 전달 분자가 비활성화되거나 분해되지 않도록 보호한다고 알려져 있다. 수학적 모델링을 통한 연구에 의하면 스캐폴드 단백질과 결합하지 않은 인산화효소는 그들이 후속 타겟과의 인산화 과정이 일어나기 전에 탈인산화효소에 의해 탈인산화가 일어날 가능성이 매우 높았다.[8]
각주[편집]
- ↑ 가 나 Shaw, A.S. and E.L. Filbert, Scaffold proteins and immune-cell signalling. Nat Rev Immunol, 2009. 9(1): p. 47–56.
- ↑ Choi, Kang-Yell; Satterberg, Brett; Lyons, David M.; Elion, Elaine A. (1994). “Ste5 tethers multiple protein kinases in the MAP kinase cascade required for mating in S. cerevisiae”. 《Cell》 78 (3): 499–512. doi:10.1016/0092-8674(94)90427-8. ISSN 0092-8674.
- ↑ 가 나 다 Levchenko, A., J. Bruck, and P.W. Sternberg, Scaffold proteins may biphasically affect the levels of mitogen-activated protein kinase signaling and reduce its threshold properties. Proc Natl Acad Sci U S A, 2000. 97(11): p. 5818–23.
- ↑ Ferrell, J.E., Jr., What do scaffold proteins really do? Sci STKE, 2000. 2000(52): p. PE1.
- ↑ Burack, W.R. and A.S. Shaw, Signal transduction: hanging on a scaffold. Curr Opin Cell Biol, 2000. 12(2): p. 211–6.
- ↑ Good, M., et al., The Ste5 scaffold directs mating signaling by catalytically unlocking the Fus3 MAP kinase for activation. Cell, 2009. 136(6): p. 1085–97.
- ↑ Wong, W. and J.D. Scott, AKAP signalling complexes: focal points in space and time. Nat Rev Mol Cell Biol, 2004. 5(12): p. 959–70.
- ↑ 가 나 다 Locasale, J.W., A.S. Shaw, and A.K. Chakraborty, Scaffold proteins confer diverse regulatory properties to protein kinase cascades. Proc Natl Acad Sci U S A, 2007. 104(33): p. 13307–12.
- ↑ Uhlik, M.T., et al., Wiring diagrams of MAPK regulation by MEKK1, 2, and 3. Biochem Cell Biol, 2004. 82(6): p. 658–63.
