성체줄기세포
성체줄기세포(영어: adult stem cell)는 성체의 조직 혹은 기관에 존재하고 있는 특이적인 세포유형으로 분화가 가능하고 자기복제를 할 수 있는 미분화된 세포의 집단을 뜻한다.[1] 이들은 세포들을 지지하고 연결하는 틈새, 미세환경이라 불리는 특이적인 환경 내에서 존재하며 외부의 유해한 자극으로부터 적절한 신호가 활성화 되기 전까지 정지된 상태를 유지하고 있다가 조직과 기관의 자극과 손상을 받았을 때 미세환경에서 벗어나 증식하고 그에 맞는 특이적인 세포로 분화하여 대체하고 기관의 구조나 기능을 유지하는 역할을 한다. 결론적으로, 성체줄기세포는 세포를 유지 ,재생, 회복의 역할을 수행하며 기관과 조직 내 항상성을 유지한다. 추가적으로, 성체줄기세포에 대한 과학자들의 관심은 무기한으로 분열 또는 자기 재생하는 능력에 초점을 두고 있으며, 그들이 생성 한 장기의 모든 세포 유형을 생성하여 잠재적으로 소수의 세포에서 전체 장기를 재생시킬 수 있다.[2] 배아줄기세포(embryonic stem cell)와는 달리, 연구 및 치료에서 인간 성체 줄기 세포의 사용은 과학적 연구를 위해 지정된 인간 배아가 아닌 성인 조직 샘플로부터 유래되기 때문에 배아줄기세포가 가진 윤리적인 문제 및 논란으로부터 벗어날 수 있다.
배아줄기세포 vs 성체줄기세포[편집]
| 배아줄기세포 | 성체줄기세포 |
|---|---|
| 배아의 내세포괴
(냉동된 배아로부터 제작) |
인체의 모든 장기에 분포 |
| 무한대로 증식 가능 | 제한적 |
| 만능성(pluripotency) | 다분화능(multipotency) |
| 이식 시 종양발생의 가능성이 높음 | 이식 시 유전자형이 맞으면 부작용 거의 없음 |
| 윤리적 문제가 있음 | 윤리적 문제가 거의 없음 |
성체 줄기세포의 특성[편집]
자기 재생(Self-renewal)[편집]
미분화 상태를 유지하면서 수많은 세포 분열 주기를 거치는 능력을 뜻함.
다분화능(Multipotency) 또는 다분화 잠재력(Multidifferentiative potential)[편집]

만능성 줄기세포와는 달리 다능성 줄기세포는 일반적으로 특정 계통으로 제한되어 분화, 즉 특정 기능을 갖는 특이적인 세포로 분화되는 것을 의미한다.[4] 자세하게는, 전구세포(progenitor cell)에서 더욱 세분화된 특성을 가진 자손세포를 생성할 수 있는 능력을 의미한다. 예를 들면, 조혈모세포( hematopoietic stem cell)에서 혈액 내 여러세포 (적혈구,혈소판,호산구,호염구,단핵구 등)로 분화하여 생성되는 것, 또는 중간엽 줄기세포 (Mesenchemal stem cell)가 연골세포(Born marrow cell)[5], 심장세포 (cardiac cell)[6], 지방세포(adipocyte)[7]로 분화할 수 있는 것을 의미한다.
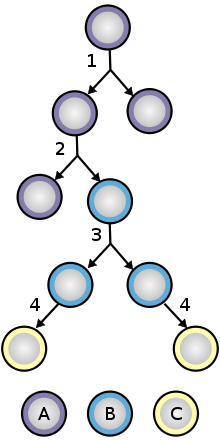
비대칭적 분열(Asymmetric division)[편집]
먼저, 대칭적 분열(Symmetric division)은 두개의 동일한 딸세포로 만드는 것을 뜻한다. 반면, 비대칭적 분열은 제한된 자기 재생 능력을 갖는 줄기세포 하나와 전구세포(progenitor cell) 하나를 생성한다. 이러한 비대칭적 분열을 거치면서 줄기세포는 자기 재생능력과 특정 세포로 분화할 수 있는 전구세포 두 가지를 얻을 수 있다.[8] 정상적인 상황에서 조직줄기세포(tissue stem cell)은 아주 느리면서도 적은 횟수의 분열을 한다. 그리고 정지, 혹은 가역적인 성장주기를 오가게 된다. 이 때, 줄기세포 틈새(stem cell niche)는 정지상태를 유지하게 해주기도 하고, 세포가 손상되었을 때 이를 대체하고 복원될 때까지 활발히 작용하도록 유도한다.그래서 이러한 기작으로 외부신호에 대한 반응으로 세포주기를 조절하는 능력은 정지상태와 활성상태 사이의 변화된 균형에 따라 줄기세포의 고갈 또는 손실을 방지하는 데 도움이 된다.[9] 예를 들면, 조혈줄기세포에서 MAPK/ERK 신호경로 및 PI3K/AKT/mTOR 신호경로가 이러한 과정에 관여한다고 알려져 있다.[10]
가소성(Plasticity)[편집]
성체줄기세포가 가지고 있는 또 하나의 중요한 특징은 가소성 혹은 분화의 유연성으로서, 이는 본래의 세포가 가지고 있던 분화의 프로그램과 다른 종류의 세포로 분화하는 것을 말한다.[11] 최근 몇 년 간의 과학적 발견은 성체줄기세포가 다른 배아층과 세포유형으로 분화하는 능력을 가질 수 있다고 제안했다. 발생단계에서 나타나는 유연성(developmental plasticity)의 대표적인 예는 2000년 Clarke 연구팀에서 밝힌 바와 같이 성체가 된 쥐의 뇌로부터 뇌신경전구체들의 집락에 해당하는 신경반구(neurosphere)를 발생중인 쥐의 배아반포에 주입한 후 그곳에서 발생한 태아의 각 조직을 조사했다. 주입된 신경반구의 세포는 그 본래 태생이 외배엽성 발생기원을 가졌음에도 불구하고 심장,위,내장(이들은 내배엽성발생기원) 등 모든 발생기원의 세포들을 포함하고 있는 것을 확인한 연구결과가 있다.[12] 그리고 2001년 Krause 팀의 연구에서는 성인 쥐의 조혈모세포를 분리한 후, 다른 쥐에게 이식하고, 이들에게 이식된 염색된 조혈모세포를 한개씩 발생중인 배아반포에 주입하여 세포의 분화과정을 추적하였다. 그 결과, 이식된 조혈모세포들이 혈액을 비롯한 신체 내의 모든 장기를 구성하고 있는 사실을 밝혔고 이를 통해 하나의 세포단위에서 분화유연성이 증명되었다.[13]
줄기세포 내 틈새 혹은 미세환경(Stem cell niche)[편집]
틈새 혹은 미세환경(Niche) 은 생체 내 또는 시험 관내 줄기 세포의 주변 미세 환경을 지칭 할 수 있다.[14] 예를 들면, 배아 발달 동안에 다양한 틈새 인자는 배아 줄기 세포에 작용하여 유전자 발현을 조절하고 태아의 발달을 위한 증식 또는 분화를 유도하게 된다. 그리고 체내에서 줄기 세포 틈새는 세포를 정지상태(Quiescent state)로 유지하지만 조직 손상 후 주변 미세 환경은 줄기 세포에 능동적으로 신호를 보내 자체 재생 또는 분화를 촉진하여 새로운 조직을 형성한다. 이는 여러 요소에 의해 조절된다. 예를 들어, 줄기 세포 사이의 세포-세포 상호 작용(Cell-cell interaction), 줄기 세포와 주변의 분화된 세포 사이의 상호 작용, 줄기 세포와 접착 분자 간의 상호 작용, 세포 외 매트릭스(Matrix) 성분, 산소 장력, 성장 인자(Growth factor), 사이토 카인(Cytokine) 및 pH, 이온 강도(예 : Ca2 + 농도) 및 ATP와 같은 대사 물질을 포함한 환경의 물리 화학적 특성도 중요하다.[15] 네이처(NATURE) 학술지에서는 틈새(Niche) 및 미세환경에 대해 다음과 같이 정의하고 있다. "줄기세포 집단은 조직 생성, 유지 보수 및 복구에 참여하는 방법을 규제하는 특정 해부학적 위치인 틈새,미세환경을 이용한다. 이것은 줄기세포가 고갈되는 것을 막아주면서 과도한 줄기세포의 증식으로부터 인체를 보호한다. 그리고 유기체에서 필요한 줄기세포의 균형잡힌 반응을 매개하는 신호를 통합하는 조직생리학의 기본 단위를 구성한다. 그러나 이 틈새환경은 줄기세포 또는 다른표적에 비정상적인 기능을 유발하여 병리를 유발 할 수 있다. 결론적으로, 줄기세포와 이 틈새환경 사이의 상호작용은 조직을 유지하고 줄기세포 치료제의 궁극적인 도구로서 사용될 수 있으며 줄기세포가 위치하고 있는 장소로서는 이 틈새환경을 충분히 설명할 수는 없으며 이 틈새환경은 해부학적, 기능적인 것들을 모두 갖추어야 한다."[16]
종류[편집]
조혈모세포 (Hematopoietic stem cell)[편집]
조혈모세포는 모든 혈액세포로 분화할 수 있는 줄기세포를 말한다.[17] 이들은 골수(Boremarrow) 와 재대혈(Umbilical cord blood)에 위치하고 있다.[18] 조혈모세포는 모든 혈액세포로 분화하는 '조혈'이라는 과정을 거치게 되는데, 이는 조혈줄기세포 틈새환경인 특별한 환경을 필요로 하며 자신을 유지하거나 분화를 수행하는데 필요한 신호를 제공한다.[19] 조혈모세포를 유지하는 역할을 하는 성장인자들은 대표적으로 줄기세포인자인 SCF(stem cell factor)[20], 케모카인 리간드12 인 CXC-chemokine ligand 12 (Cxcl-12)[21]가 있다. 그리고 조혈줄기세포에게 틈새환경을 제공하기 위해서는 다양한 세포와의 상호작용이 필요한데 예를 들면 조혈모세포, 골수세포, 거대세포, 단핵구 및 대식세포 등이 있다.[22] 조혈세포가 존재하는 골수 내에는 중간엽줄기세포에서 분화된 골 전구세포, 골모세포를 포함하여 다양한 세포가 존재하며, 골수 내 세포들과 물리적접촉(physical contact)을 하거나 확산인자(diffusible factors)를 통해 조혈모세포 조절에 영향을 미친다고 알려져 있다.[23]
중간엽줄기세포 (Mesenchymal stem cell)[편집]
중간엽줄기세포는 골수에 위치하고 있으며 조골세포, 연골세포, 근육세포, 지방세포로 분화가 가능한 줄기세포이다. 여러 연구에 따르면 중간엽줄기세포는 거의 모든 성인조직에서 혈관과 연결되어 있다고 밝혔으며,[24] 이 세포와 상호작용하며 조절되는 세포로는 인간 골수에 존재하는 섬유아세포, 내피세포, 조골세포, 파골세포, 지방세포 및 면역세포들을 포함한다. 그 중에서도 1차 골 유래 조골세포(primary bone‐derived osteoblasts)와 밀접적으로 접촉하는 중간엽줄기세포는 골유도제(덱사메타손,β- 글리세로 포스페이트 및 아스 코르 베이트)가 존재하는 경우 증식 및 골 형성 분화를 겪게 되고 그에 해당하는 유전자 발현이 향상된다는 결과가 발표되었다.[25] 그리고 중간필라멘트인 비멘틴(Vimentin)이 중간엽줄기세포에서 연골형성에 필요하고 분화과정을 조절한다는 연구결과로서 발표된 바가 있다.[26]
신경줄기세포 (Neural stem cells)[편집]
성체 뇌에서 줄기세포의 존재는 새로운 뉴런의 만들어지는 신경생성과정이 계속 된다는 발견[27]으로 시작되어 성숙한 영장류 뇌에서 줄기세포의 존재가 1967년에 처음 보고되었다.[28] 이들은 일반적으로 신경구(neurosphere)에서부터 유래하고, 뉴런 및 신경아교세포로 분화할 수 있다.
장줄기세포 (Intestinal stem cell)[편집]
장상피는 빠르게 재생되는 세포구획이다. 이 지속적인 재생은 장 내를 유지하는 장 항상성의 특징이며, 장 줄기세포의 증식과 분화사이의 조절과 균형이 필요하다. 장 상피세포는 병원성 환경인자(미생물,바이러스)와 직접적으로 접촉하기 때문에 더욱 적극적으로 분열해야한다. 따라서 손상유발, 장의 재생동안 장줄기세포의 활성을 유지하는 틈새환경을 이해하는 것이 중요하다. 장줄기세포는 주로 Lgr5라는 마커를 발현하고 있으며 이는 모든 다른 장상피세포의 유형으로 분화할 수 있다.[29]
근육줄기세포 (Muscle stem cell, Myosatellite cell)[편집]
근육줄기세포는 성숙한 근육에서 발견되는 세포질이 거의 없는 다능성 세포이다. 이들은 기저막(basement membrane)과 근섬유를 싸고 있는 막(sarcolemma) 사이에 위치한다.[30] 근육줄기세포는 기존 근육 섬유를 증강시키고 새로운 섬유를 형성하기 위해 분화 및 융합 될 수있다. 이 세포는 가장 알려진지 오래된 성체줄기세포이며 근육의 정상적인 성장뿐만 아니라 부상이나 질병에 따른 재생에 관여한다. 근육세포가 손상을 입을 때, 정지위성세포(quiescent satellite cells)는 기저막 아래에서 방출되어 세포주기가 활성된다.[31] 이를 통해 태아 근육발달과 유사한 과정을 통해 새로운 근섬유를 형성한다. 여러번의 세포분열 후 손상된 근관과 융합하기 시작하고 특징적인 말초 핵과 함께 추가 분화와 성숙을 겪는다.[32]이 근육줄기세포의 분화와 증식에 관여하는 인자는 인슐린성 성장인자 IGF-1으로 알려져 있다.[33]
모낭줄기세포 (hair folliclestem cell)[편집]
모낭줄기세포(hair follicle stem cell)는 모낭의 돌출부(bulge)에 위치하고 있다. 이들은 상피(epithelial)와 피지선 기저세포(sebaceous gland basal cell), 모낭(hair follicle)을 구성하고 있으며,[34] 모발과 모낭의 재생 및 성장, 급성 상피 상처의 복구에 관여한다.[35] 모낭은 일시적인 성장주기를 거치는데 성장주기인 아나젠(Anagen), 변성주기인 카타젠(Catagen), 휴지기인 텔로젠(telogen)을 겪는다. 이 시기에 따라 모낭줄기세포는 성장과 정지상태를 오가면서 행동하게 된다.[36]
내피줄기세포 (Endothelial stem cell)[편집]
내피줄기세포는 골수에서 발견되며 내피세포(endothelial cell)를 생산하여 혈관과 림프관 내부 표면을 감싸는 얇은 벽 내피를 만든다.[37]
치료적측면[편집]
성체줄기세포를 이용한 치료는 수년동안 골수이식을 이용하여 백혈병 이나 혈액 암을 성공적으로 치료하기 위해서 사용되어 왔다.[38] 또한 혈액전구체인 조혈모세포를 정맥 내로 전달하는데 초점을 맞추고 있으며 조혈모세포를 활용한 척추손상[39], 간경변[40] 및 말초혈관질환을 포함한 다양한 질병을 치료하기 위해 사용되고 있으며 중간엽줄기세포에도 중점을 두어 초기 응용 단계에 있다. 두 세포주 모두에서 혈관전달이 정맥 내 주사된 세포가 폐에 1차적으로 통과하기 때문에 치료가 필요한 부위에 직접적으로 주사하는 것이 바람직한 치료방법이 될 것이라는 보고서도 발표된 바가 있다.[41] 하지만 성체줄기세포가 배아줄기세포보다는 안전성이 확보되었다고 해도 이 치료법에 대한 규제나 기준이 명확하게 정해져있지 않기 때문에 효과가 있다고 하더라도 과장된 부분이 존재할 수 있다는 문제점도 있다.[42] 또한 세포제공자의 상태와 제조공정에 따라 전염성질환이나 세포제공자가 가지고 있는 질환이 내재되어 있다가 투여받는 환자에게 감염되거나 질환이 생길 수 있다. 이를 최소화 하기 위해 임상시험을 통해 관리되고 있지만 과학적,기술적 한계로 인해 감지하지 못하는 경우도 있기 때문에 이러한 부작용이 생길 수 있다.[43] 그리고 치료효과의 지속성이나 높은수준의 개선효과를 기대하기가 어려운 점이 있어 이를 개선하기 위해 다양한 방법들을 적용함으로써 치료효과를 높이기 위한 연구들이 시도되고 있다. 예를 들면, 세포 내에 특정 유전자를 삽입하는 방법, 화학물질(chemical)이나 저분자단백질(small peptide) 등의 전처리 혹은 온도나 빛을 조절하여 세포의 배양환경에 변화를 유도하는 방법이 있다.[44]
각주[편집]
- ↑ ^Johnson Rajasingh(2018). "Adult Stem Cells for Regenerative Therapy."Progress in Molecular Biology and Translational Science.(2018) Volume 160 ISSN 1877-1173 doi.org/10.1016/bs.pmbts.2018.07.009.
- ↑ ^ Mahla RS (2016). "Stem cells application in regenerative medicine and disease threpeutics". International Journal of Cell Biology. 2016 (7): 19. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.
- ↑ http://www.ksmcb.or.kr/file/bio_2013/lectures/profile_07.pdf
- ↑ ^María Berdasco & Manel Esteller.DNA methylation in stem cell renewal and multipotency.Stem Cell Research & Therapy volume 2, Article number: 42 (2011)
- ↑ Ohgushi H, Arima N, Taketani T (December 2011). "[Regenerative therapy using allogeneic mesenchymal stem cells]". Nippon Rinsho (in Japanese). 69 (12): 2121–7. PMID 22242308.
- ↑ Ohgushi H, Arima N, Taketani T (December 2011). "[Regenerative therapy using allogeneic mesenchymal stem cells]". Nippon Rinsho (in Japanese). 69 (12): 2121–7. PMID 22242308.
- ↑ Ohgushi H, Arima N, Taketani T (December 2011). "[Regenerative therapy using allogeneic mesenchymal stem cells]". Nippon Rinsho (in Japanese). 69 (12): 2121–7. PMID 22242308.
- ↑ Culurgioni, S; Mari, S; Bonetti, P; Gallini, S; Bonetto, G; Brennich, M; Round, A; Nicassio, F; Mapelli, M (2018). "Insc:LGN tetramers promote asymmetric divisions of mammary stem cells". Nat Commun. 9 (1): 1025. Bibcode:2018NatCo...9.1025C. doi:10.1038/s41467-018-03343-4. PMC 5844954. PMID 29523789.
- ↑ So, WK; Cheung, TH (2018). Molecular Regulation of Cellular Quiescence: A Perspective from Adult Stem Cells and Its Niches. Methods in Molecular Biology. 1686. pp. 1–25. doi:10.1007/978-1-4939-7371-2_1. ISBN 978-1-4939-7370-5. PMID 29030809.
- ↑ Baumgartner, C; Toifl, S; Farlik, M; Halbritter, F; Scheicher, R; Fischer, I; Sexl, V; Bock, C; Baccarini, M (2018). "An ERK-Dependent Feedback Mechanism Prevents Hematopoietic Stem Cell Exhaustion". Cell Stem Cell. 22 (6): 879–892.e6. doi:10.1016/j.stem.2018.05.003. PMC 5988582. PMID 29804890.
- ↑ 김 영 인 · 오 일 환,"성체줄기세포의 세포학적 특성(Cell Biological Characteristics of Adult Stem Cells), 대한의사협회"
- ↑ Clarke DL, Johansson CB, Wilbertz J, Veress B, Nilsson E, Frisen J, et al. Generalized potential of adult neural stem cells. Science 2000; 288: 1660 - 3
- ↑ Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Sharkis SJ, et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell 2001; 105: 369 -7 7.
- ↑ Birbrair, Alexander; Frenette, Paul S. (2016). "Niche heterogeneity in the bone marrow". Annals of the New York Academy of Sciences. 1370 (1): 82–96. Bibcode:2016NYASA1370...82B. doi:10.1111/nyas.13016. PMC 4938003. PMID 27015419
- ↑ Jhala, Dhwani. (2015). "A review on extracellular matrix mimicking strategies for an artificial stem cell niche". Polymer Reviews. 55 (4): 561–595. doi:10.1080/15583724.2015.1040552.
- ↑ Scadden, David T. (2006). "The stem-cell niche as an entity of action". Nature. 441 (7097): 1075–9. Bibcode:2006Natur.441.1075S. doi:10.1038/nature04957. PMID 16810242.
- ↑ umbilical cord blood.[
- ↑ "Medical Definition of Hematopoiesis". MedicineNet. Archived from the original on 14 March 2017. Retrieved 21 February 2020.
- ↑ ^ Jump up to: a b c d Birbrair, Alexander; Frenette, Paul S. (2016-03-01). "Niche heterogeneity in the bone marrow". Annals of the New York Academy of Sciences. 1370 (1): 82–96. Bibcode:2016NYASA1370...82B. doi:10.1111/nyas.13016. ISSN 1749-6632. PMC 4938003. PMID 27015419.
- ↑ Ogawa, M. et al. Expression and function of c-kit in hemopoietic progenitor cells. J. Exp. Med. 174, 63–71 (1991).
- ↑ Nagasawa, T. et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 382, 635–638 (1996).
- ↑ Genevieve M. Crane, Elise Jeffery & Sean J. Morrison,"Adult haematopoietic stem cell niches" Nature Reviews Immunology volume 17, pages573–590(2017)
- ↑ 중간엽줄기세포 및 골 전구세포가 조혈모세포 유지에 미치는 영향, 분자세포생물학 뉴스레터 참고.http://www.ksmcb.or.kr/file/webzine/2013_08_01.pdf
- ↑ (Shi and Gronthos, 2003; da Silva Meirelles et al., 2006; Crisan et al., 2008)
- ↑ (Csaki) et al (2009),"Synergistic chondroprotective effects of curcumin and resveratrol in human articular chondrocytes: inhibition of IL-1β-induced NF-κB-mediated inflammation and apoptosis"
- ↑ Nastaran Z. Kuhn, Rocky S. Tuan"Regulation of stemness and stem cell niche of mesenchymal stem cells: Implications in tumorigenesis and metastasis" (2009),doi.org/10.1002/jcp.21940|
- ↑ ^Altman J, Das GD (June 1965). "Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats". The Journal of Comparative Neurology. 124 (3): 319–35. doi:10.1002/cne.901240303. PMID 5861717.
- ↑ Lewis PD (March 1968). "Mitotic activity in the primate subependymal layer and the genesis of gliomas". Nature. 217 (5132): 974–5. Bibcode:1968Natur.217..974L.
- ↑ António J.M. Santos,1 Yuan-Hung Lo,1 Amanda T. Mah,1 and Calvin J. Kuo1,"The Intestinal Stem Cell Niche: Homeostasis and Adaptations" Trends in Cell Biology, December 2018, Vol. 28, No. 12 https://doi.org/10.1016/j.tcb.2018.08.001
- ↑ Zammit, PS; Partridge, TA; Yablonka-Reuveni, Z (November 2006). "The skeletal muscle satellite cell: the stem cell that came in from the cold". Journal of Histochemistry and Cytochemistry. 54 (11): 1177–91. doi:10.1369/jhc.6r6995.2006. PMID 16899758.
- ↑ Birbrair, A.; Delbono, O. (2015). "Pericytes are Essential for Skeletal Muscle Formation". Stem Cell Reviews and Reports. 11 (4): 547–548. doi:10.1007/s12015-015-9588-6. PMID 25896402.
- ↑ ^ Jump up to: a b Parker MH, Seale P, Rudnicki MA (July 2003). "Looking back to the embryo: defining transcriptional networks in adult myogenesis". Nat. Rev. Genet. 4 (7): 497–507. doi:10.1038/nrg1109. PMID 12838342.
- ↑ Mourkioti F, Rosenthal N (October 2005). "IGF-1, inflammation and stem cells: interactions during muscle regeneration". Trends Immunol. 26 (10): 535–42. doi:10.1016/j.it.2005.08.002. PMID 16109502.
- ↑ Joanna Wojtkiewicz "Therapeutic Potential of Stem Cells in Follicle Regeneration" Volume 2018 |Article ID 1049641 | 16 pages | doi.org/10.1155/2018/1049641
- ↑ Robert M. Hoffman & Yasuyuki Amoh,"Hair-follicle-associated pluripotent stem cells derived from cryopreserved intact human hair follicles sustain multilineage differentiation potential"Scientific Reports volume 9, Article number: 9326 (2019)
- ↑ Xiaoyang Wang, Yizhan Xing, Yuhong Li, Identification and Characterization of Hair Follicle Stem Cells (2018) Somatic Stem Cellspp 69-80|
- ↑ Fang S, Wei J, Pentinmikko N, Leinonen H, Salven P (16 October 2012). Goodell MA (ed.). "Generation of functional blood vessels from a single c-kit+ adult vascular endothelial stem cell". PLOS Biology. 10 (10): e1001407. doi:10.1371/journal.pbio.1001407. PMC 3473016. PMID 23091420.
- ↑ Bone Marrow Transplant Retrieved on 21 November 2008
- ↑ ^Srivastava A, Bapat M, Ranade S, Srinivasan V, Murugan P, Manjunath S, Thamaraikannan P, Abraham S (2010). "Autologous Multiple Injections of in Vitro Expanded Autologous Bone Marrow Stem Cells For Cervical Level Spinal Cord Injury – A Case Report". Journal of Stem Cells and Regenerative Medicine.
- ↑ ^ Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K, Yamasaki T, Fujii Y, Okita K, Sakaida I (2006). "Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy". Stem Cells. 24 (10): 2292–2298. doi:10.1634/stemcells.2005-0542. PMID 16778155.
- ↑ ^ Fischer UM, Harting MT, Jimenez F, et al. (June 2009). "Pulmonary passage is a major obstacle for intravenous stem cell delivery: the pulmonary first-pass effect". Stem Cells and Development. 18 (5): 683–692. doi:10.1089/scd.2008.0253. PMC 3190292. PMID 19099374.
- ↑ PR Newswire. "The International Society for Stem Cell Research Releases New Guidelines to Shape Future of Stem Cell Therapy Regulation needed as new study reveals clinics exaggerate claims and omit risks
- ↑ www.nifds.go.kr › cont › down
- ↑ ^한국줄기세포학회. "성체줄기세포의 기능개선을 위한 임상연구동향" http://www.ksscr.org/rang_board/list.html?num=1006&code=rnd Archived 2020년 6월 20일 - 웨이백 머신
