길랑-바레 증후군
 | |
|---|---|
| 진료과 | 신경외과 |
| 증상 | 손발의 말초부에서 시작되는 근무력증 |
길랑-바레 증후군(길랑바레 증후군, 길랭바레 증후군, 영어: Guillain–Barré syndrome, GBS) 또는 급성감염성다발신경염(영어: Acute Inflammatory Demyelinating Polyneuropathy, AIDP) 혹은 특발성다발신경근염은 말초신경계통의 손상으로 급격하게 근 무력이 시작되는 병이다.
발병시 다수는 감각의 변화를 경험하며 통증을 느끼고 이어 손과 발에 근무력증이 시작된다. 증상은 반나절부터 4주간에 걸쳐 진행된다. 급성기 동안 약 15%의 환자가 호흡 근육이 약화되어 인공호흡이 필요할 정도로 생명에 위협을 받는다. 일부는 자율신경계통이 기능 이상을 일으켜 심박수와 혈압에 위험할 정도의 이상을 초래하기도 한다.
이 증후군은 자가면역질환으로, 몸의 면역계가 말초신경계를 잘못 공격하여 말이집 절연체를 손상시킴으로 발생된다. 감염에 의해 유발되기도 한다. 진단은 통상 징후와 증상에 의하며, 대체 가능한 원인들을 배제하고 신경전도 연구와 같은 검사와 뇌척수액 조사로 뒷받침된다. 약해진 부위, 신경전도 연구의 결과, 안티강글리오시드 항체의 존재 여부 등에 따라 다양하게 분류된다. 이 증후군은 급성 다발신경병으로 분류된다.
무력증이 심한 환자들은 면역글로불린을 정맥주사하거나 혈장분리반출술을 간호와 병행하여 즉시 치료하면 대부분 잘 회복된다. 일부는 걸음이 점차 어려워지거나, 고통이 있거나, 장기간 인공 호흡을 필요로 하기도 한다. 길랑-바레 증후군의 발생은 드물어서 매년 10만 명당 2건 정도로 발생한다.
명칭은 1916년 프랑스의 신경학자인 G. 길랑(Georges Guillain)과 장 바레(Jean Alexandre Barré)가 처음으로 기술한 것에서 기인한다.
징후 및 증상[편집]
길랑-바레 증후군의 첫 번째 증상은 무감각, 저림, 고통이 단독적으로나 복합적으로 나타난다. 그리고는 다리와 팔의 힘이 약해지며 양쪽 모두 시간이 경과함에 따라 점차 심해진다.[1] 힘이 없어지는 것은 가장 심한 수준에 이르기까지 반나절에서 4주까지 걸릴 수 있으며, 이후로는 변동이 없다.[1] 4주까지 진행되는 것은 5명당 1명 정도이다.[2] 목 근육 또한 영향을 받을 수 있으며, 절반 가까이는 머리와 얼굴을 담당하는 뇌신경에 이상이 생기기도 한다. 이로부터 안면 근육이 약해지고, 음식을 삼키기 어려워지며, 때로는 눈근육불완전마비가 올 수 있다.[2] 그중 8%는 발에만 영향(대마비 또는 대부전마비)을 준다.[2] 방광과 항문 근육이 영향을 받는 경우는 드물다.[1] 통틀어 길랑-바레 증후군 환자의 약 1/3은 계속 걸을 수 있다.[2] 일단 약화가 진행을 멈추면 병세가 호전되기 전까지 안정된 수준이 유지된다.(편평기) 편평기는 2일에서 6개월까지 이를 수 있으나, 보통은 1주 정도 지속된다.[2] 절반 이상은 고통에 관련된 증상이 있는데, 요통, 아플 정도의 저림, 근육통, 수막증을 포함한다.[2]
길랑-바레 증후군 환자의 다수는 신경계 증상이 발생하기 3~6주 전에 감염의 징후와 증상을 겪었다. 여기에는 상기도감염(비염, 인두통)이나 설사가 포함될 수 있다.[1]
어린이, 특히 6세 이하에서는 진단이 어려울 수 있으며, 초기에는 종종 고통과 보행의 어려움 등의 증상이 다른 원인, 예를 들면 바이러스 감염이나 뼈나 관절의 문제에 의한 것으로 오인된다.[2][3]
신경학적검사법에서의 특징은 힘이 줄거나 신장반사가 줄거나 없어지는 것이다.(반사저하와 무반사) 어쨌든, 소수의 환자들에서 무반사가 발생하기 전의 팔과 다리의 반사는 정상적이며, 일부에서는 지나친 반사를 보이기도 한다.[2] 길랑-바레 증후군의 ‘밀러 피셔 변종’ 아형에서는 눈근육불완전마비가 더 많고 운동실조를 동반하기도 한다.[1] 길랑-바레 증후군에서는 보통 의식수준이 영향을 받지 않지만, 비커스태프 뇌간 뇌염 아형은 나른함, 졸림, 혼수가 나타나기도 한다.[4]
호흡부전[편집]
길랑-바레 증후군 환자들 증 1/4은 호흡에 사용되는 근육이 약해져 호흡 부전에 이르는데, 이 경우 환자는 피 속에 건강한 수준의 산소와 이산화탄소를 유지할 수 있을 정도의 충분한 숨을 쉴 수 없게 된다.[1][2][5] 이는 생명을 위협하며, 인공 호흡을 필요로 하는 환자의 60%에서는 폐렴, 패혈증, 폐색전, 위장출혈 같은 또 다른 의료문제로 합병이 된다.[1]
자율신경 기능장애[편집]
길랑-바레 증후군 환자들 중 2/3는 심박수, 혈압과 같은 신체의 기능을 통제하는 데에 관여하는 자율신경이 영향을 받으나, 그 영향은 가변적이다.[2] 20%는 극심한 혈압 변동과 심부정맥을 겪고, 때로는 심장무수축으로 인공 심박조율기에 기반한 치료가 필요해지기도 한다.[1] 관련된 다른 문제로 땀과 동공 반응에 이상이 생기기도 한다.[6] 자율신경계 관련 문제는 근 무력증이 심하지 않은 환자에도 영향을 줄 수 있다.[6]
원인[편집]
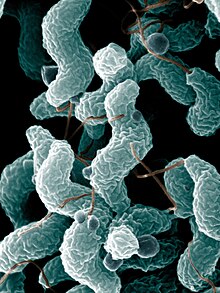
길랑-바레 증후군 환자의 2/3은 발병 전에 감염이 있다. 가장 흔한 경우는 장염이나 기도감염이다. 많은 경우, 정확한 감염의 본질을 확인할 수 있다.[2] 발병의 약 30%는 설사를 유발하는 캄필로박터 제주니 박테리아가 원인이 된다. 10%는 거대세포바이러스(CMV, HHV-5)에 원인이 있다. 하지만, 소수의 사람들만이 '캄필로박터'나 CMV의 감염이 길랑-바레 증후군으로 발전한다(순서대로 1000명당 0.25~0.65건, 1000명당 0.6~2.2건).[1] 관련된 '캄필로박터'의 종류가 이 병의 위험도를 결정할 수도 있다. 서로 다른 종류의 박테리아는 그 표면의 지질다당질도 서로 다르며, 일부는 병을 일으키고 일부는 그렇지 않을 수도 있다.[2]
다른 감염과 길랑-바레 증후군(GBS)과의 연관은 그리 분명하지는 않다. 서로 다른 헤르페스바이러스 엡스타인바 바이러스/HHV-4와 수두대상포진바이러스/HHV-3, 그리고 폐렴미코플라스마 박테리아가 GBS와 관련되었다.[1] 열대 바이러스 감염 댕기열은 GBS의 발병에 관련되어 왔다.[7] 예전의 E형간염바이러스의 감염에서는 길랑-바레 증후군 환자들에서 더 흔하게 발견되었다.[2] 지카 바이러스도 GBS에 연관되었다.[8]
일부는 인플루엔자 바이러스에 의해, 잠재적으로는 인플루엔자 백신에 의해 유발되었을 수 있다. 1976년의 돼지 인플루엔자 유행 (H1N1 A/NJ/76) 후 인플루엔자 예방접종 이후로 길랑-바레 증후군의 발생이 증가하였다. 접종자 1백만 명 중 8.8건이 합병증을 일으켰다. 이후로 백신 접종에 기인하는 건에 대한 근접 모니터링으로 인플루엔자 자체로 GBS를 유발할 수 있음이 입증되었다. 이후의 백신 접종 운동에서 약간의 발병 증가가 관찰되었으나 같은 정도는 아니었다.[9] 2009년의 독감 대유행 백신(대유행 돼지 바이러스 H1N1/PDM09 대응)은 주목할 만한 발병 증가를 유발하지 않았다.[1] 백신 접종의 이득은 접종 후의 GBS의 작은 위험성보다 크다.[10] 예전에 길랑-바레 증후군에 걸렸던 사람들도 장래에 백신을 접종하는 것이 안전하다고 여겨진다.[2] 소아마비, 파상풍, 홍역 등 다른 백신들은 GBS의 위험과 관련되지 않았다.[3]
기제[편집]
| 뉴런 |
|---|
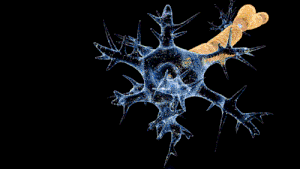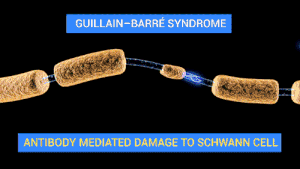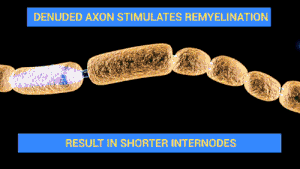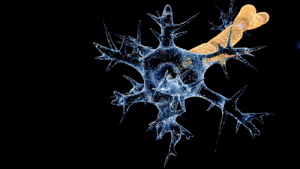
길랑-바레 증후군의 신경 기능 장애는 말초신경계의 신경 세포 및 지지 구조에 대한 면역 공격에 의해 발생된다. 신경 세포는 척수 안에 세포체가 있으며, 자극이 근육으로 전달되는 신경근육이음부로 전기적 신경 자극을 전해 주는 축삭이 있다. 축삭은 말이집을 함유하는 슈반세포의 초에 감싸여 있다. 슈반 세포들 사이에는 축삭이 노출되는 틈(신경섬유마디, 랑비에 결절)이 있다.[1] 길랑-바레 증후군은 그 종류에 따라 다양한 면역 장애의 특징을 보인다. '말이집탈락 변이'(AIDP)는 백혈구(T세포)와 대식세포에 미엘린 초가 손상을 입는다. 이러한 과정은 보체로 알려져 있는 혈액 단백질 무리의 활성화에 의해 진행된다. 반면, 축삭 변이는 림프구의 직접적인 관여 없이 면역글로불린 G와 축삭집에 대한 보체에 의해 조정된다.[1]
신경세포를 향한 다양한 항체가 길랑-바레 증후군에서 보고되었다. 축삭의 아형에서 말초신경계에서 발견되는 물질군인 강글레오시드에 엉겨 있는 항체들이 줄곧 발견되었다. 강글레오시드는 6탄당 유형의 소집단에 부착된 세라미드로 구성, 다양한 수의 N-아세틸뉴라민산 집단을 포함하는 분자이다. 앞서의 항체와 관련된 중요한 네 강글레오시드는 GM1, GD1a, GT1a, GQ1b 로, 서로 다른 항(抗)강글레오시드 항체가 특정한 특징과 관련되어 있다. 예를 들면, GQ1b 항체는 밀러 피셔 변형 GBS 와 브커스태프 뇌염에 관련된 형태에 연관되었다.[1] 이러한 항체들의 감염 후 생성은 면역체계가 미생물에 반응하면서 생성한 항체가 체내에서 자연적으로 존재하는 물질에도 반응하는 분자모방의 결과일 수 있다.[1][11] 캄필로박터 감염 후 체내에서는 면역글로불린 A(lgA) 류의 항체가 생성되며, 소수의 사람들이 박테리아 세포벽 물질(예를 들면, Lipopolysaccharide)에 대한 lgG 항체를 또한 생성하여 사람의 신경 세포의 강글레오시드와 교차반응한다. 이러한 과정이 어떻게 강글레오시드에 대한 중추 관용(central tolerance)으로부터 벗어나는지는 현재까지 알려져 있지 않다.[12] 모든 항-강글레오시드 항체가 질병을 유발하지는 않으며, 최근에는 일부 항체들은 동시에 한 가지 유형의 항원결정인자에 묶여 있음이 시사되기도 했다.[12]
치료법[편집]
이 문단의 내용은 출처가 분명하지 않습니다. (2016년 2월) |
현재까지 치료법은 알려지지 않았지만 혈장교환과 면역억제요법을 사용하며, 주로 대증요법을 시행한다. 오랜 기간 침대에 누워있게 되므로 욕창이 생길 수 있기 때문에 주의해야 하며, 대소변 기능장애가 나타날 수 있으므로 적절한 조치를 취해야 한다. 호흡부전증이 있는 경우에는 인공호흡기를 사용하고 물리치료를 실시하기도 한다.
각주[편집]
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 Nobuhiro Yuki, Hans-Peter Hartung (2012년 6월 14일). “Guillain–Barré Syndrome”. 《New England Journal of Medicine》 366 (24): 2294~2304. doi:10.1056/NEJMra1114525. PMID 22694000.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 Bianca van den Berg, Christa Walgaard, Judith Drenthen, Christiaan Fokke, Bart C. Jacobs, Pieter A. van Doorn (2014년 7월 15일). “Guillain–Barré syndrome: pathogenesis, diagnosis, treatment and prognosis”. 《Nature Reviews Neurology》 10 (8): 469~482. doi:10.1038/nrneurol.2014.121. PMID 25023340.
- ↑ 가 나 Monique M. Ryan (2013년 12월). “Pediatric Guillain-Barré syndrome”. 《Current Opinion in Pediatrics》 25 (6): 689~693. doi:10.1097/MOP.0b013e328365ad3f. PMID 24240288.
- ↑ N. Shahrizaila, N. Yuki (2012년 9월 15일). “Bickerstaff brainstem encephalitis and Fisher syndrome: anti-GQ1b antibody syndrome”. 《Journal of Neurology, Neurosurgery & Psychiatry》 84 (5): 576~583. doi:10.1136/jnnp-2012-302824. PMID 22984203.
- ↑ van Doorn PA, Kuitwaard K, Walgaard C 외 (2010년 5월). “IVIG treatment and prognosis in Guillain-Barré syndrome”. 《Journal of Clinical Immunology》. 30 Suppl 1: S74~8. doi:10.1007/s10875-010-9407-4. PMC 2883091. PMID 20396937.
- ↑ 가 나 Pieter A van Doorn, Liselotte Ruts, Bart C Jacobs (2008년 10월). “Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome”. 《The Lancet Neurology》 7 (10): 939~950. doi:10.1016/S1474-4422(08)70215-1. PMID 18848313.
- ↑ Carod-Artal FJ, Wichmann O, Farrar J, Gascón J (2013년 9월). “Neurological complications of dengue virus infection”. 《The Lancet Neurology》 12 (9): 906~19. doi:10.1016/S1474-4422(13)70150-9. PMID 23948177.
- ↑ Alain Kohl, Derek Gatherer (2015년 12월 18일). “Zika virus: a previously slow pandemic spreads rapidly through the Americas”. 《Journal of General Virology》. doi:10.1099/jgv.0.000381.
- ↑ Lehmann HC, Hartung HP, Kieseier BC, Hughes RA (2010년 9월). “Guillain-Barré syndrome following influenza vaccination”. 《The Lancet Infectious Diseases》 10 (9): 643~51. doi:10.1016/S1473-3099(10)70140-7. PMID 20797646.
- ↑ Simon Rinaldi (2013년 6월). “Update on Guillain-Barré syndrome”. 《Journal of the Peripheral Nervous System》 18 (2): 99~112. doi:10.1111/jns5.12020. PMID 23781958.
- ↑ Kuwabara S, Yuki N (2013년 12월). “Axonal Guillain-Barré syndrome: concepts and controversies”. 《The Lancet Neurology》 12 (12): 1180~8. doi:10.1016/S1474-4422(13)70215-1. PMID 24229616.
- ↑ 가 나 Hugh J. Willison, Carl S. Goodyear (2013년 9월). “Glycolipid antigens and autoantibodies in autoimmune neuropathies”. 《Trends in Immunology》 34 (9): 453~459. doi:10.1016/j.it.2013.05.001. PMID 23770405.
같이 보기[편집]
외부 링크[편집]
- (영어) 길랑-바레 증후군 - Curlie

